Ассоциация и ассоциация регулярных протеинов как способ регуляции ферментативной активности
Протеинкиназы — группа ферментов, катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (вызывают фосфорилирование белков). Механизмы активации различных протеинкиназ неодинаковы. В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно привести регуляцию активности фермента Протеинкиназы А.
Протеинкиназа А (цАМФ-зависимая) состоит из 4 субъединиц 2 типов: 2 регуляторных (R) и 2 каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3′,5′-АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы.Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации регуляторных и каталитических субъединиц протеинкиназы А с образованием неактивного комплекса.
Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента.
Рассмотрим механизм частичного протеолиза на примере активации протеолитического фермента трипсина. Трипсиноген, синтезируемый в поджелудочной железе, при пищеварении по протокам поджелудочной железы поступает в двенадцатиперстную кишку, где и активируется путём частичного протеолиза под действием фермента кишечника энтеропептидазы. В результате отщепления гексапептида с N-конца формируется активный центр в оставшейся части молекулы. Следует напомнить,
что трипсин относят к семейству «сериновых» протеаз — активный центр фермента содержит функционально важный остаток Сер.
Частичный протеолиз — пример регуляции, когда активность фермента изменяется необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы.Частичный протеолиз лежит в основе активации протеолитических ферментов, белков свёртывающей системы крови и фибринолиза, белков системы комплемента, а также пептидных гормонов.
Кофакторы ферментов: торы металла и коферменты.
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).Большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора — кофермента. Белковая часть-«апофермент», который в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
Кофакторы.
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов.
Роль металлов в присоединении субстрата
В активном центре фермента
Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования (на примере ферментов синтеза и распада гликогена).
В
биологических системах часто встречается
механизм регуляции активности ферментов
с помощью ковалентной модификации
аминокислотных остатков. Быстрый и
широко распространённый способ химической
модификации ферментов —
фосфорилирование/дефосфорилирование.
Модификации подвергаются ОН-группы
фермента. Фосфорилирование осуществляется
ферментами протеинкиназами, а
дефосфорилирование — фосфопротеинфосфатазами.
Присоединение остатка фосфорной кислоты
приводит к изменению конформации
активного центра и его каталитической
активности. При этом результат может
быть двояким: одни ферменты при
фосфорилировании активируются, другие,
напротив, становятся менее активными
.
Изменение
активности фермента, вызванное
фосфорилированием, обратимо. Отщепление
остатка фосфорной кислоты осуществляется
ферментами фосфопротеинфосфатазами.
Активность протеинкиназ и
фосфопротеинфосфатаз регулируется
гормонами, что позволяет быстро изменять
активность ключевых ферментов
метаболических путей в зависимости от
условий внешней среды. Антагонистичные
по функции гормоны противоположным
образом влияют на фосфорилирование/дефосфорилирование
ферментов, вызывая противоположные
эффекты изменения метаболизма клетки.Например,
под действием глюкагона (в период между
приёмами пищи) в клетках происходит
уменьшение синтеза энергетического
материала — жира, гликогена и усиление
его распада (мобилизация), вызванного
фосфо-рилированием ключевых ферментов
этих процессов. А под действием инсулина
(во время пищеварения), наоборот,
активируется синтез гликогена и
ингибируется его распад, так как
взаимодействие инсулина с рецептором
активирует сигнальный путь, приводящий
к дефосфорилированию тех же ключевых
ферментов.
20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
В
качестве примера регуляции каталитической
активности ферментов ассоциацией или
диссоциацией протомеров можно привести
регуляцию активности фермента
протеинкиназы А. Протеинкиназа А
(цАМФ-зависимая) состоит из 4 субъединиц
2 типов: 2 регуля-торных (R) и 2 каталитических
(С). Такой тетрамер не обладает
каталитической активностью. Регуляторные
субъединицы имеют участки связывания
для циклического 3′,5′-АМФ (цАМФ), по 2 на
каждую субъединицу. Присоединение 4
молекул цАМФ к 2 регуляторным субъединицам
приводит к изменению конформации
регуляторных протомеров и к диссоциации
тетрамерного комплекса, при этом
высвобождаются 2 активные каталитические
субъединицы . Такой механизм регуляции
обратим. Отщепление молекул цАМФ от
регуляторных
субъединиц
приведёт к ассоциации регуляторных и
каталитических субъединиц протеинкиназы
А с образованием неактивного комплекса.
Некоторые
ферменты, функционирующие вне клеток
(в ЖКТ или в плазме крови), синтезируются
в виде неактивных предшественников и
активируются только в результате
гидролиза одной или нескольких
определённых пептидных связей, что
приводит к отщеплению части белковой
молекулы предшественника. В результате
в оставшейся части белковой молекулы
происходит конформационная перестройка
и формируется активный центр фермента.
Частичный
протеолиз — пример регуляции, когда
активность фермента изменяется
необратимо. Такие ферменты функционируют,
как правило, в течение короткого времени,
определяемого временем жизни белковой
молекулы. Частичный протеолиз лежит в
основе активации протеолитических
ферментов, белков свёртывающей системы
крови и фибринолиза, белков системы
комплемента, а также пептидных гормонов.
Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров.
Протеинкиназы — группа ферментов, катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных (серин, треонин, тирозин или гетероциклической аминогруппы гистидина) остатков белков (вызывают фосфорилирование белков). Механизмы активации различных протеинкиназ неодинаковы. (Геном человека содержит около пятисот генов протеинкиназ, которые составляют около двух процентов всех генов. Протеинкиназы регулируют клеточный цикл, рост и дифференцировку клеток, апоптоз. Нарушения работы протеинкиназ приводят к различным патологиям, в том числе, к возникновению некоторых видов рака.Для лечения опухолей такой этиологии разрабатывают лекарства, ингибирующие специфические протеинкиназы).
Протеинкиназа А(цАМФ-зависимая) состоит из 4 субъединиц 2 типов: 2 регуляторных (R) и 2 каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3′,5′-АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы. Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации регуляторных и каталитических субъединиц Протеинкиназы А с образованием неактивного комплекса.
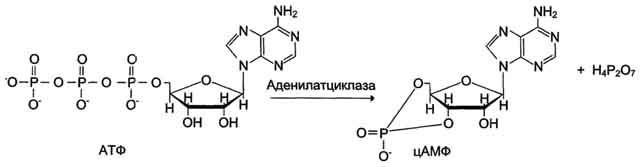
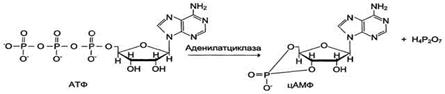
Регуляция активности аденилатциклазы. Гормон (Г), взаимодействуя с рецептором (R) на поверхности клеток, приводит к уменьшению сродства ГТФ-связывающего белка (G-белка, состоящего из протомеров α, β, γ) к ГТФ и увеличению сродства к ГТФ. Присоединение молекулы ГТФ к активному центру G-белка вызывает диссоциацию комплекса на субъединицы α-ГТФ и димер βγ. Комплекс α-ГТФ активирует аденилатциклазу, что способствует синтезу из АТФ внутриклеточных регуляторных молекул цАМФ. АЦ — аденилатциклаза, ПКА — протеинкиназа А, Рi — Н3РО4.
ТЕМА 2.8. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
1.Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути (последовательного превращения одних веществ в другие), достаточно регулировать количество молекул фермента или их активность. Обычно в метаболических путях имеются ключевые ферменты,за счет которых происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами.Регуляция скорости ферментативных реакций осуществляется на трех независимых уровнях: изменением количества молекул фермента, доступностью молекул субстрата и кофермента, изменением каталитической активности молекулы фермента (табл. 2.6).
Таблица 2.5. Способы регуляции скорости ферментативных реакций
| Способ регуляции | Характеристика |
| Изменение количества молекул фермента | Количество молекул фермента в клетке определяется соотношением двух процессов: синтеза и распада. Наиболее изучен механизм регуляции синтеза фермента на уровне транскрипции (синтеза мРНК), который регулируется определенными метаболитами, гормонами и рядом биологически активных молекул |
| Доступность молекул субстрата и кофермента | Важный параметр, контролирующий протекание ферментативной реакции, — наличие субстрата и кофермента. Чем больше концентрация исходного субстрата, тем выше скорость реакции |
| Изменение каталитической активности молекулы фермента | Основными способами регуляции активности ферментов являются:
— аллостерическая регуляция; — регуляция с помощью белок-белковых взаимодействий; — регуляция путем фосфорилирования-дефосфорилирова- ния молекулы фермента; — регуляция частичным (ограниченным) протеолизом |
Рассмотрим способы регуляции скорости ферментативных реакций за счет изменения каталитической активности молекулы фермента.
2. Аллостерическая регуляция. Аллостерическими ферментаминазывают ферменты, активностькоторых может регулироватьсяс помощью веществэффекторов.Участвующие в аллостерической регуляции эффекторы — это клеточные метаболиты, которые часто являются участниками именно того пути, регуляцию которого они осуществляют.
Эффектор, который вызывает снижение (ингибирование)активности фермента, называется ингибитором.Эффектор, который вызываетповышение (активацию)активности ферментов, называют активатором.
Аллостерические ферменты имеют определенные особенности строения:
— обычно являются олигомерными белками,состоящими из нескольких протомеров;
— имеют аллостерический центр,пространственно удаленный от каталитического активного центра;
— эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах.
Аллостерические центры, так же как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие — к ингибиторам.
Протомер, на котором находится аллостерический центр, называется регуляторным протомеромв отличие от каталитического протомера,содержащего активный центр, в котором проходит химическая реакция.
Аллостерические ферменты обладают свойством кооперативности:взаимодействие аллостерического эффектора с аллостерическим центром вызывает кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или повышает каталитическую активность фермента. Если к аллостерическому центру присоединяется ингибитор, то в результате кооперативных конформационных изменений происходит изменение конформации активного центра, что вызывает снижение сродства фермента к субстрату и, соответственно, снижение скорости ферментативной реакции. И наоборот, если к аллостерическому центру присоединяется активатор, то сродство фермента к субстрату увеличивается, что вызывает повышение скорости реакции. Последовательность событий при действии аллостерических эффекторов представлена на рис. 2.26.
Регуляция аллостерических ферментов обратима:отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента.
Аллостерические ферменты катализируют ключевые реакцииданного метаболического пути.
Аллостерические ферменты играют важную роль в различных метаболических путях, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состава клетки. Скорость метаболических процессов зависит от концентрации веществ, как использующихся, так и образующихся в данной цепи реакций. Исходные вещества могут быть активаторами аллостерических ферментов метаболического пути. В то же время при накапливании конечного продукта какого-либо метаболического пути он может действовать как аллостерический ингибитор фермента. Такой способ регуляции распространен в организме и носит название «отрицательная обратная связь»:
Рис. 2.26. Схема строения и функционирования аллостерического фермента:
А — действие отрицательного эффектора (ингибитора). Ингибитор (I) присоединяется к аллостерическому центру, что вызывает кооперативные конформационные изменения в молекуле фермента, в том числе и в активном центре фермента. Сродство фермента к субстрату снижается, в результате снижается и скорость ферментативной реакции; Б — действие положительного эффектора (активатора). Активатор (А) присоединяется к аллостерическому центру, что вызывает кооперативные конформационные изменения. Сродство фермента к субстрату повышается, и скорость ферментативной реакции увеличивается. Продемонстрировано обратимое действие как ингибитора, так и активатора на активность фермента
Рассмотрим аллостерическую регуляцию процесса катаболизма глюкозы, который заканчивается образованием молекулы АТФ (рис. 2.27). В том случае, если молекулы АТФ в клетке не расходуются, она является ингибитором аллостерических ферментов данного метаболического пути: фосфофруктокиназы и пируваткиназы. В то же время промежуточный метаболит катаболизма глюкозы — фруктозо-1,6-бисфосфат является аллостерическим активатором фермента пируваткиназы. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяет
Рис. 2.27. Аллостерическая регуляция процесса катаболизма глюкозы.
Молекула АТФ является аллостерическим ингибитором ферментов метаболического пути — фосфофруктокиназы и пируваткиназы. Молекула фруктозо-1,6-бисфосфата является аллостерическим активатором фермента пируваткиназы
осуществлять регуляцию скорости метаболического пути. Аллостерические ферменты катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте разветвления метаболического пути.
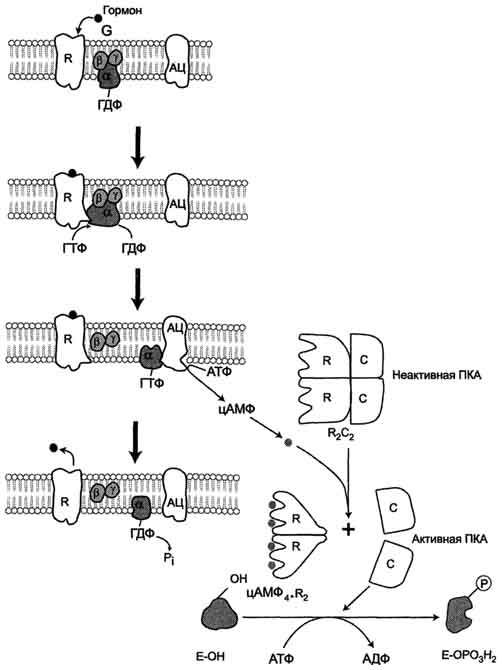
3. Регуляция с помощью белок-белковых взаимодействий.Некоторые ферменты изменяют свою активность в результате белок-белковых взаимодействий. Можно выделить по крайней мере два механизма изменения активности фермента таким способом: активация ферментов в результате присоединения белков-активаторов (активация фермента аденилатциклазы с помощью α-субъединицы G-белка, см. модуль 4) и изменение каталитической активности в результате ассоциации и диссоциации протомеров.
В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно рассмотреть регуляцию фермента протеинкиназы А.
Протеинкиназа А(цАМФ-зависимая) состоит из четырех субъединиц двух типов: двух регуляторных (R) и двух каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3′,5′-АМФ (цАМФ) (по два на каждую субъединицу). Присоединение четырех молекул цАМФ к двум регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса; при этом высвобождаются две активные каталитические субъединицы (рис. 2.28). Активная протеинкиназа А катализирует перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (т.е. вызывает фосфорилирование белков).
Рис. 2.28. Регуляция активности протеинкиназы А (ПКА) с помощью белок-белковых взаимодействий.
Активация ПКА осуществляется с помощью четырех молекул цАМФ, которые присоединяются к двум регуляторным субъединицам, что приводит к изменению конформации регуляторных протомеров и диссоциации тетрамерного комплекса. При этом высвобождаются две активные каталитические субъединицы, способные вызывать фосфорилирование белков
Отщепление молекул цАМФ от регуляторных субъединиц приводит к ассоциации регуляторных и каталитических субъединиц протенкиназы А с образованием неактивного комплекса.
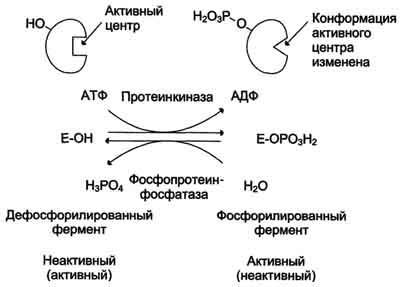
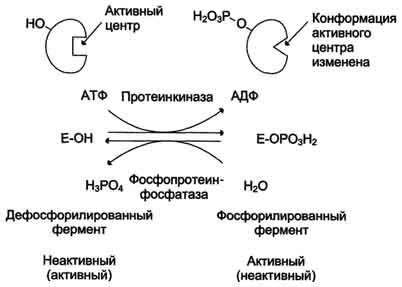
4. Регуляция каталитической активности ферментов путем фосфорилирова- ния-дефосфорилирования.В биологических системах часто встречается механизм регуляции активности ферментов с помощью их ковалентной модификации. Быстрым и широко распространенным способом химической модификации ферментов является их фосфорилирование-дефосфорилирование.
Фосфорилирова-нию подвергаются ОН-группы фермента, которое осуществляется ферментами протеинкиназами(фосфорилирование) ифосфопротеинфосфатазами(дефосфорилирование). Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными (рис. 2.29). Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро варьировать активность ключевых ферментов метаболических путей в зависимости от условий внешней среды.
Рис. 2.29. Схема регуляции активности ферментов фосфорилированием-дефосфорилированием.
Фосфорилирование ферментов происходит с помощью фермента протеинкиназы. Донором остатка фосфорной кислоты является молекула АТФ. Фосфорилирование фермента изменяет его конформацию и конформацию активного центра, что изменяет сродство фермента к субстрату. При этом некоторые ферменты при фосфорилировании активируются, другие — ингибируются. Обратный процесс — дефосфорилирование — вызывают ферменты фосфопротеинфосфатазы, отщепляющие остаток фосфорной кислоты от фермента и возвращающие фермент в исходное состояние
5. Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом.Некоторые ферменты, которые функционируют вне клеток (в желудочно-кишечном тракте или плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определенных пептидных связей, который приводит к отщеплению части молекулы. В оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента (рис. 2.30). Частичный протеолиз представляет собой пример регуляции, когда активность фермента изменяется
Рис. 2.30. Активация пепсина с помощью частичного протеолиза.
В результате гидролиза одной или нескольких пептидных связей пепсиногена (неактивной молекулы) отщепляется часть молекулы и формируется активный центр фермента пепсина
необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации пищеварительных протеолитических ферментов (пепсин, трипсин, химотрипсин, эластаза), пептидных гормонов (инсулин), белков свертывающей системы крови и ряда других белков.
19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
В
биологических системах часто встречается
механизм регуляции активности ферментов
с помощью ковалентной модификации
аминокислотных остатков. Быстрый и
широко распространённый способ химической
модификации ферментов —
фосфорилирование/дефосфорилирование.
Модификации подвергаются ОН-группы
фермента. Фос-форилирование осуществляется
ферментами протеинкиназами, а
дефосфорилирование — фосфопротеинфосфатазами.
Присоединение остатка фосфорной кислоты
приводит к изменению конформации
активного центра и его каталитической
активности. При этом результат может
быть двояким: одни ферменты при
фосфорилировании активируются, другие,
напротив, становятся менее активными.
Изменение
активности фермента, вызванное
фосфорилированием, обратимо. Отщепление
остатка фосфорной кислоты осуществляется
ферментами фосфопротеинфосфатазами.
Активность протеинкиназ и фосфопротеинфосфатаз
регулируется гормонами, что позволяет
быстро изменять активность ключевых
ферментов метаболических путей в
зависимости от условий внешней среды.
Антагонистичные по функции гормоны
противоположным образом влияют на
фосфо-рилирование/дефосфорилирование
ферментов, вызывая противоположные
эффекты изменения метаболизма клетки.
Например,
под действием глюкагона (в период между
приёмами пищи) в клетках происходит
уменьшение синтеза энергетического
материала — жира, гликогена и усиление
его распада (мобилизация), вызванного
фосфо-рилированием ключевых ферментов
этих процессов. А под действием инсулина
(во время пищеварения), наоборот,
активируется синтез гликогена и
ингибируется его распад, так как
взаимодействие инсулина с рецептором
активирует сигнальный путь, приводящий
к дефосфорилированию тех же ключевых
ферментов.
20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции протеолитической активности ферментов.
Протеинкиназы
— группа ферментов, катализирующих
перенос остатка фосфорной кислоты с
АТФ на специфические ОН-группы
аминокислотных остатков белков (вызывают
фосфорилирование белков). Механизмы
активации различных протеинкиназ
неодинаковы. В качестве примера регуляции
каталитической активности ферментов
ассоциацией или диссоциацией протомеров
можно привести регуляцию активности
фермента Протеинкиназы А.
Протеинкиназа
А (цАМФ-зависимая)
состоит из 4 субъединиц 2 типов: 2
регуляторных (R) и 2 каталитических (С).
Такой тетрамер не обладает каталитической
активностью. Регуляторные субъединицы
имеют участки связывания для циклического
3′,5′-АМФ (цАМФ), по 2 на каждую субъединицу.
Присоединение 4 молекул цАМФ к 2
регуляторным субъединицам приводит к
изменению конфор-мации регуляторных
протомеров и к диссоциации тетрамерного
комплекса, при этом высвобождаются 2
активные каталитические субъединицы
(рис. 2-32). Такой механизм регуляции
обратим. Отщепление молекул цАМФ от
регуляторных субъединиц приведёт к
ассоциации регуляторных и каталитических
субъединиц Протеинкиназы А с образованием
неактивного комплекса.
Регуляция
каталитической активности ферментов
частичным (ограниченным) протеолизом
Некоторые
ферменты, функционирующие вне клеток
(в ЖКТ или в плазме крови), синтезируются
в виде неактивных предшественников и
активируются только в результате
гидролиза одной или нескольких
определённых пептидных связей, что
приводит к отщеплению части белковой
молекулы предшественника. В результате
в оставшейся части белковой молекулы
происходит конформационная перестройка
и формируется активный центр фермента.
Рассмотрим
механизм частичного протеолиза на
примере активации протеолитического
фермента трипсина (рис. 2-34). Трип-синоген,
синтезируемый в поджелудочной железе,
при пищеварении по протокам поджелудочной
железы поступает в двенадцатиперстную
кишку, где и активируется путём частичного
протеолиза под действием фермента
кишечника энтеропептидазы. В результате
отщепления гексапептида с N-конца
формируется активный центр в оставшейся
части молекулы. Следует напомнить, что
трипсин относят к семейству «сериновых»
протеаз — активный центр фермента
содержит функционально важный остаток
Сер.
Частичный
протеолиз — пример регуляции, когда
активность фермента изменяется
необратимо. Такие ферменты функционируют,
как правило, в течение короткого времени,
определяемого временем жизни белковой
молекулы. Частичный протеолиз лежит в
основе активации протеолитических
ферментов, белков свёртывающей системы
крови и фибринолиза, белков системы
комплемента, а также пептидных гормонов.
Диссоциация и ассоциация белковых молекул
Ферменты, молекулы которых состоят из нескольких полипептидных цепей, диссоциируют на субъединицы под влиянием тех же агентов, какие обычно используются для денатурации белков. Для некоторых белков хорошо исследован процесс ассоциация — диссоциация. Рассмотрим два наибо-,п ее подробно изученных в этом отношении белка — глутаматдегидрогеназу и альдолазу. Молекула глутаматдегидрогеназы обладает тремя типами организации на уровне четвертичной структуры. Непосредственно после выделения ее молекулярный вес составляет от 1,0-10 до 1,3-10 (определения по скорости седиментации и диффузии). В результате диссоциации фермента, которая стимулируется восстановленным НАДФ, некоторыми пуриновыми нуклеотидами или просто разбавлением фермента, получаются субъединицы [c.116]
Общим фундаментальным механизмом, посредством которого реализуются биологические эффекты вторичных мессенджеров внутри клетки, является процесс фосфорилирования — дефосфорилирования белков при участии широкого разнообразия протеинкиназ, катализирующих транспорт концевой группы от АТФ на ОН-группы серина и треонина, а в ряде случаев—тирозина белков-мишеней. Процесс фосфорилирования представляет собой важнейшую посттрансляционную химическую модификацию белковых молекул, коренным образом изменяющую как их структуру, так и функции. В частности, он вызывает изменение структурных свойств (ассоциацию или диссоциацию составляющих субъединиц), активирование или ингибирование их каталитических свойств, в конечном итоге определяя скорость химических реакций и в целом функциональную активность клеток. [c.290]
Он состоит из двух идентичных субъединиц а М 53 000) и (7И57 000) их аминокислотные последовательности в значительной степени гомологичны, что указывает на дупликацию гена в ходе эволюции. Микротрубочки — полимеры тубулина. Тринадцать линейных протофиламентов субъединиц тубулина составляют структуру трубочки, так что поперечное сечение имеет ось симметрии 13-го порядка, а вид -сбоку представляет упакованные по спирали субъединицы (рис. 10.5). Процессы ассоциации отдельных молекул тубулина н диссоциации микротрубочек находятся в равновесии, на которое влияют различные параметры (температура, концентрации Са + и GTP, фосфорилирование). Очень чистый тубулин образует микротрубочки только в условиях высокой концентрации белка и магния. В клетке действуют и другие факторы, видимо, влияющие на [c.311]
Модель Эдера является самой общей из возможных моделей связывания лиганда чистым неассоциирующим белком в равновесных условиях. Под чистым белком понимается белок, способный находиться в различных изомерных формах, равновесие между которыми устанавливается очень быстро кроме того, подразумевается, что изомеризация не включает процессы диссоциации—ассоциации белка. Рассмотрим модель Эдера для белка, содержащего четыре связывающих центра на молекулу и представленного двумя находящимися в равновесии формами — активной (Е) и неактивной (Е ) [c.173]
В последнее время для этой цели широко используются различного рода метки флюоресцентные, свободнорадикальные и др. [71—75]. Первым указанием на изменение структуры белка при связывании аллостерических эффекторов послужили данные по изменению степени диссоциации— ассоциации регуляторных ферментов под действием аллостерических эффекторов [76, 77]. По-видимому, изменение прочности связей между субъединицами в ферментативном олигомере является очень чувствительным тестом на конфор-мационные изменения белковой молекулы при связывании аллостерических эффекторов. Обнаружено, например, что [c.105]
Во многих случаях конформационные изменения белков связаны с ассоциацией или диссоциацией субъединиц. Маловероятно, что такие процессы могут протекать достаточно быстро, чтобы они были существенны при каждом превращении молекулы субстрата, так что их роль, по-видимому, сводится к контролю ферментативной активности. На вопрос, связаны ли все эти процессы с изменением конформации отдельных субъединиц, до настоящего времени не было найдено определенного ответа, однако весьма вероятно, что в большинстве случаев такие изменения имеют место, и было бы весьма удивительно, если бы столь большие структурные перестройки происходили бы без соответствующего конформационного изменения субъединиц. В случае щелочной фосфатазы из Е. соИ было показано, что зависящее от времени конформационное изменение кислотно диссоциирующих субъединиц должно иметь место до того, как частицы ассоциируются в нативный фермент [57]. [c.243]
В других случаях возможна обратимая диссоциация глобулы до отдельных полипептидных цепей. Для гемоглобина разделение на а-, р-цепи происходит достаточно легко, тогда как воссоединение отдельных а- и (3-цепей — трудно выполнимая задача. Однако понятие четвертичной структуры основано совсем не на возможности реконструкции фермента из отдельных субъединиц. Строгое определение четвертичной структуры означает, что в сложную глобулу фермента объединяются структурно независимые элементы — отдельные субъединицы. Если ассоциация не изменяет строения отдельных частей, то понятие четвертичной структуры приобретает ясный физический смысл. В противном случае речь идет лишь об обратимости построения сложной молекулы белка, не зависящей от иерархии структур — первичной, вторичной, третичной и четвертичной. В действительности отдельные субъединицы ферментов изменяют свои конформации при ассоциации, поэтому понятие четвертичной структуры является еще менее строгим, чем третичной или вторичной. Речь идет просто о том, что пространственное строение белковой глобулы зависит от всех межмолекулярных взаимодействий в системе. Как правило, построение глобулы белка не удается рассматривать в виде последовательности независимых процессов — скручивания цепи в спираль, укладку цепей в отдельные субъединицы и объединение независимых субъединиц. На каждом этапе происходят конформационные изменения, ч
19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
В
биологических системах часто встречается
механизм регуляции активности ферментов
с помощью ковалентной модификации
аминокислотных остатков. Быстрый и
широко распространённый способ химической
модификации ферментов —
фосфорилирование/дефосфорилирование.
Модификации подвергаются ОН-группы
фермента. Фос-форилирование осуществляется
ферментами протеинкиназами, а
дефосфорилирование — фосфопротеинфосфатазами.
Присоединение остатка фосфорной кислоты
приводит к изменению конформации
активного центра и его каталитической
активности. При этом результат может
быть двояким: одни ферменты при
фосфорилировании активируются, другие,
напротив, становятся менее активными.
Изменение
активности фермента, вызванное
фосфорилированием, обратимо. Отщепление
остатка фосфорной кислоты осуществляется
ферментами фосфопротеинфосфатазами.
Активность протеинкиназ и фосфопротеинфосфатаз
регулируется гормонами, что позволяет
быстро изменять активность ключевых
ферментов метаболических путей в
зависимости от условий внешней среды.
Антагонистичные по функции гормоны
противоположным образом влияют на
фосфо-рилирование/дефосфорилирование
ферментов, вызывая противоположные
эффекты изменения метаболизма клетки.
Например,
под действием глюкагона (в период между
приёмами пищи) в клетках происходит
уменьшение синтеза энергетического
материала — жира, гликогена и усиление
его распада (мобилизация), вызванного
фосфо-рилированием ключевых ферментов
этих процессов. А под действием инсулина
(во время пищеварения), наоборот,
активируется синтез гликогена и
ингибируется его распад, так как
взаимодействие инсулина с рецептором
активирует сигнальный путь, приводящий
к дефосфорилированию тех же ключевых
ферментов.
20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции протеолитической активности ферментов.
Протеинкиназы
— группа ферментов, катализирующих
перенос остатка фосфорной кислоты с
АТФ на специфические ОН-группы
аминокислотных остатков белков (вызывают
фосфорилирование белков). Механизмы
активации различных протеинкиназ
неодинаковы. В качестве примера регуляции
каталитической активности ферментов
ассоциацией или диссоциацией протомеров
можно привести регуляцию активности
фермента Протеинкиназы А.
Протеинкиназа
А (цАМФ-зависимая)
состоит из 4 субъединиц 2 типов: 2
регуляторных (R) и 2 каталитических (С).
Такой тетрамер не обладает каталитической
активностью. Регуляторные субъединицы
имеют участки связывания для циклического
3′,5′-АМФ (цАМФ), по 2 на каждую субъединицу.
Присоединение 4 молекул цАМФ к 2
регуляторным субъединицам приводит к
изменению конфор-мации регуляторных
протомеров и к диссоциации тетрамерного
комплекса, при этом высвобождаются 2
активные каталитические субъединицы
(рис. 2-32). Такой механизм регуляции
обратим. Отщепление молекул цАМФ от
регуляторных субъединиц приведёт к
ассоциации регуляторных и каталитических
субъединиц Протеинкиназы А с образованием
неактивного комплекса.
Регуляция
каталитической активности ферментов
частичным (ограниченным) протеолизом
Некоторые
ферменты, функционирующие вне клеток
(в ЖКТ или в плазме крови), синтезируются
в виде неактивных предшественников и
активируются только в результате
гидролиза одной или нескольких
определённых пептидных связей, что
приводит к отщеплению части белковой
молекулы предшественника. В результате
в оставшейся части белковой молекулы
происходит конформационная перестройка
и формируется активный центр фермента.
Рассмотрим
механизм частичного протеолиза на
примере активации протеолитического
фермента трипсина (рис. 2-34). Трип-синоген,
синтезируемый в поджелудочной железе,
при пищеварении по протокам поджелудочной
железы поступает в двенадцатиперстную
кишку, где и активируется путём частичного
протеолиза под действием фермента
кишечника энтеропептидазы. В результате
отщепления гексапептида с N-конца
формируется активный центр в оставшейся
части молекулы. Следует напомнить, что
трипсин относят к семейству «сериновых»
протеаз — активный центр фермента
содержит функционально важный остаток
Сер.
Частичный
протеолиз — пример регуляции, когда
активность фермента изменяется
необратимо. Такие ферменты функционируют,
как правило, в течение короткого времени,
определяемого временем жизни белковой
молекулы. Частичный протеолиз лежит в
основе активации протеолитических
ферментов, белков свёртывающей системы
крови и фибринолиза, белков системы
комплемента, а также пептидных гормонов.
Субмодальность диссоциации ассоциации
Паттерн диссоциации ассоциации является мощным регулятором состояния. Представьте, что вы решили поехать в отпуск, но сначала нужно накопить. Что с большей вероятностью поможет вам сэкономить деньги?
Association
Вы представляете себе большой яркий фильм о месте назначения. Он в 3D, поэтому вы чувствуете, что можете дотронуться до его частей. Слышна музыка и звуки — есть манящий ритм. Это как если бы вы действительно были там, наблюдая это своими глазами.Ваш внутренний голос говорит: «Я действительно хочу туда, не могу дождаться!» Стивен Спилберг позавидовал бы твоим производственным способностям.
С другой стороны, фобия — это результат застревания в связанном состоянии. Схема лечения фобии НЛП включает в себя изменение этого ассоциированного состояния на состояние диссоциированного наблюдателя. Всякий раз, когда нас переполняют эмоции, диссоциация может стать сильным облегчением.
Диссоциация
Думайте о пункте назначения как о маленьком черно-белом снимке.Если вы там, вы можете увидеть себя, а не своими глазами. Ваш внутренний голос говорит: «Думаю, это было бы хорошо».
Использование диссоциации ассоциаций
Паттерн диссоциации ассоциаций — очень важное субмодальное различие. Когда вы связаны, вы переживаете заново опыт, у вас есть все чувства. Когда вы диссоциированы, вы наблюдаете за собой. Ваши чувства связаны с ситуацией. Это не имеет ничего общего с категорией психического здоровья «диссоциативные расстройства».
Когда нужно общаться
Когда вы переживаете или вспоминаете что-то приятное, с вами веселее общаться. Это также необходимая часть обучения навыкам, особенно такой физической активности, как спорт. Это хороший способ получить мотивацию к занятию, приносящему удовольствие.
Когда нужно расстаться
Отстраниться от неприятных воспоминаний или переживаний более полезно. Как вы мотивируете себя выполнить неприятное или трудоемкое задание? Представьте, как вы выполняете шаги задачи, и ассоциируйтесь с конечным результатом.Сосредоточьтесь на хороших чувствах, связанных с выполнением задачи.
Как сделать жизнь несчастной
Многие люди делают прямо противоположное. Они повторно переживают неприятные воспоминания и события, связанные со всеми неприятными чувствами. Они вспоминают приятные события совершенно бессвязно. Еще хуже — заняться чем-нибудь веселым, думая о подаче налоговой декларации.
Дальнейшее чтение: субмодальности переходят в мета Л. Майкл Холл
.
Мера ассоциации | статистика
Мера связи , в статистике, любой из различных факторов или коэффициентов, используемых для количественной оценки взаимосвязи между двумя или более переменными. Измерения ассоциации используются в различных областях исследований, но особенно распространены в областях эпидемиологии и психологии, где они часто используются для количественной оценки взаимосвязи между воздействием и болезнями или поведением.
Мера ассоциации может быть определена с помощью любого из нескольких различных анализов, включая корреляционный анализ и регрессионный анализ.(Хотя термины корреляция и ассоциация часто используются взаимозаменяемо, корреляция в более строгом смысле относится к линейной корреляции, а ассоциация относится к любой взаимосвязи между переменными.) Метод, используемый для определения силы ассоциации. зависит от характеристик данных для каждой переменной. Данные могут быть измерены по шкале интервалов / соотношений, порядковой / ранговой шкале или номинальной / категориальной шкале. Эти три характеристики можно рассматривать как непрерывные, целочисленные и качественные категории соответственно.
Методы анализа
Коэффициент корреляции Пирсона
Типичным примером количественной оценки связи между двумя переменными, измеренными по шкале интервалов / соотношений, является анализ взаимосвязи между ростом и весом человека. Каждая из этих двух характеристических переменных измеряется в непрерывном масштабе. Подходящей мерой связи для этой ситуации является коэффициент корреляции Пирсона, r (rho), который измеряет силу линейной связи между двумя переменными по непрерывной шкале.Коэффициент r принимает значения от -1 до +1. Значения -1 или +1 указывают на идеальную линейную связь между двумя переменными, тогда как значение 0 указывает на отсутствие линейной зависимости. (Отрицательные значения просто указывают направление ассоциации, при этом, когда одна переменная увеличивается, другая уменьшается.) Коэффициенты корреляции, которые отличаются от 0, но не являются -1 или +1, указывают на линейную зависимость, хотя и не на идеальную линейную зависимость. На практике ρ (коэффициент корреляции населения) оценивается как r , что является коэффициентом корреляции, полученным из данных выборки.
Хотя коэффициент корреляции Пирсона является мерой силы ассоциации (в частности, линейной взаимосвязи), он не является мерой значимости ассоциации. Значимость ассоциации — это отдельный анализ выборочного коэффициента корреляции, r , с использованием теста t для измерения разницы между наблюдаемым r и ожидаемым r при нулевой гипотезе.
Получите эксклюзивный доступ к контенту из нашего 1768 First Edition с подпиской.Подпишитесь сегодня
Коэффициент ранговой корреляции Спирмена
Коэффициент ранговой корреляции Спирмена (Ро Спирмена) разработан для измерения силы монотонной (в постоянном направлении) связи между двумя переменными, измеренными по порядковой или ранжированной шкале. Данные, полученные в результате ранжирования, и данные, собранные по шкале, которая по своей природе не является интервальной (например, данные, полученные в результате применения шкалы Лайкерта), подлежат корреляционному анализу Спирмена. Кроме того, любые интервальные данные могут быть преобразованы в ранги и проанализированы с помощью Spearman rho, хотя это приводит к потере информации.Тем не менее, этот подход может использоваться, например, если одна интересующая переменная измеряется по интервальной шкале, а другая — по порядковой шкале. Подобно коэффициенту корреляции Пирсона, Ро Спирмена можно проверить на его значимость. Аналогичным показателем силы ассоциации является тау Кендалла, который также может применяться для измерения силы монотонной ассоциации между двумя переменными, измеренными по порядковой или ранговой шкале.
В качестве примера подходящего случая Спирмена ро рассмотрим случай, когда существует семь существенных угроз здоровью сообщества.Руководители здравоохранения хотят определить иерархию угроз, чтобы наиболее эффективно использовать свои ресурсы. Они просят двух надежных эпидемиологов оценить семь угроз от 1 до 7, где 1 — самая серьезная угроза. Ро Спирмена или тау Кендалла можно рассчитать для измерения степени связи между рейтингами эпидемиологов, тем самым указывая на коллективную силу потенциального плана действий. Если существует значимая связь между двумя наборами рангов, должностные лица здравоохранения могут чувствовать себя более уверенными в своей стратегии, чем если бы значимая связь не очевидна.
Тест хи-квадрат
Критерий хи-квадрат для ассоциации (сопряженности) — это стандартная мера ассоциации между двумя категориальными переменными. Критерий хи-квадрат, в отличие от коэффициента корреляции Пирсона или Ро Спирмена, является мерой значимости ассоциации, а не мерой ее силы.
Далее следует простой и общий пример. Если бы ученые изучали взаимосвязь между полом и политической партией, то они могли бы подсчитать людей из случайной выборки, принадлежащих к различным комбинациям: женщина-демократ, женщина-республиканец, мужчина-демократ и мужчина-республиканец.Затем ученые могли выполнить тест хи-квадрат, чтобы определить, было ли значительное непропорциональное членство среди этих групп, указывающее на связь между полом и политической партией.
Относительный риск и отношение шансов
В частности, в эпидемиологии используется несколько других мер связи между категориальными переменными, включая относительный риск и отношение шансов. Относительный риск целесообразно применять к категориальным данным, полученным в результате эпидемиологического когортного исследования.Он измеряет силу ассоциации, рассматривая частоту события в идентифицируемой группе (числитель) и сравнивая ее с частотой в базовой группе (знаменатель). Относительный риск, равный 1, указывает на отсутствие связи, тогда как относительный риск, отличный от 1, указывает на связь.
В качестве примера предположим, что у 10 из 1000 человек, подвергшихся воздействию фактора X, развился рак печени, в то время как только у 2 из 1000 человек, никогда не подвергавшихся воздействию X, развился рак печени. В этом случае относительный риск будет (10/1000) / (2/1000) = 5.Таким образом, сила связи равна 5, или, если интерпретировать иначе, вероятность развития рака печени у людей, подвергшихся воздействию X, в пять раз выше, чем у людей, не подвергавшихся воздействию X. Если относительный риск был меньше 1 (возможно, 0,2, например ), то сила связи была бы столь же очевидной, но с другим объяснением: воздействие X снижает вероятность рака печени в пять раз, указывая на то, что X обладает защитным эффектом. Категориальные переменные — это воздействие X (да или нет) и исход рака печени (да или нет).Однако этот расчет относительного риска не проверяет статистическую значимость. На важные вопросы можно ответить, рассчитав 95% доверительный интервал. Если доверительный интервал не включает 1, связь считается значимой.
Точно так же отношение шансов является подходящей мерой силы ассоциации для категориальных данных, полученных в результате исследования случай-контроль. Отношение шансов часто интерпретируется таким же образом, что относительный риск интерпретируется при измерении прочности ассоциации, хотя это несколько спорным, когда фактор риска изучается является общим.
.
определение диссоциации в Медицинском словаре
В целом, этой книге удалось показать, что процесс отделения Полри от военной структуры продвинул перспективы независимости и профессионализма, хотя есть много серьезных проблем, которые следует решать. Наваф Салам был тем, кто выступил с политикой диссоциации. 3 августа прошлого года он настоял на том, чтобы Ливан не поддержал голосование по заявлению Совета Безопасности, в котором осуждались «широкомасштабные нарушения прав человека, совершаемые сирийскими властями в отношении гражданского населения.«Это позволило опубликовать декларацию в то время, потому что она не была бы принята, если бы Ливан проголосовал против. В то время как некоторые колледжи продолжают работать по расписанию, поскольку учителя решили не отвечать Ассоциации преподавателей Делиского университета (DUTA)» В связи с призывом к разъединению руководители других учреждений надеются на решение в связи с циркуляром, разосланным университетом. Были некоторые предположения, что разъединение было поспешным решением, принятым в результате разногласий между отдельными членами региона 3 и национальный орган.Были определены диапазоны движения внутреннего подшипника, а затем компоненты были подвергнуты механическому испытанию для определения силы разъединения внутреннего подшипника на вырыв, а также статических и динамических сил соударения для разъединения. Рабочая группа, разрабатывающая IEEE 802.11w, сосредоточена на повышении безопасности управления 802.11 фреймы, включая, но не ограничиваясь ими, фреймы управления действиями и фреймы деаутентификации и диссоциации ». Мы выросли с 12% до более чем 20%, и такое увеличение происходит только из-за растущей диссоциации с лейбористами.Джексон отказался комментировать какие-либо проблемы со своей командой юристов, но позже его лагерь подал официальное уведомление о разъединении. Компания HEC-Labs, основанная в 1996 году, разработала технологии, позволяющие более экономно использовать энергию солнца и снижать температуру, необходимую для разделение воды и более экономичное производство водорода из ископаемого топлива. Их также попросили подписать «заявление об отказе от действий Генерального Синода» по вопросу однополых отношений.Шаблоны напряженности также вызывают эмоциональный стресс и душевные страдания, такие как беспокойство, депрессия, разобщение, безнадежность и смирение. Дополняя защищенные IPSec беспроводные возможности SOHO TZW, SonicOS 2.0 теперь предоставляет дополнительные функции безопасности, такие как обнаружение и защита от мошеннические точки доступа, атаки с разъединением и атаки с наводнением ассоциаций.
,
protomers — определение — английский
Примеры предложений с «protomers», память переводов

 WikiMatrix Фасад состоит из двух этажей с элегантным порталом, увенчанным протомером львом, и большим балконом, опирающимся на кронштейны, работающими по причинам фитоформи (т.е. соединенными в растительный мир).
WikiMatrix Фасад состоит из двух этажей с элегантным порталом, увенчанным протомером львом, и большим балконом, опирающимся на кронштейны, работающими по причинам фитоформи (т.е. соединенными в растительный мир). 
 WikiMatrix В пятом веке до нашей эры храм имел черепичную крышу с разноцветным декором в ионической традиции, с львиными протомами и горгульями.
WikiMatrix В пятом веке до нашей эры храм имел черепичную крышу с разноцветным декором в ионической традиции, с львиными протомами и горгульями. 
 Giga-fren Полученный таким образом протомер, спинин, стабилен в этих условиях и повторно объединяется при охлаждении с образованием двух различных нитевидных полимерных структур, которые различаются по своей стабильности, конформации белка и характеристикам реассоциации.
Giga-fren Полученный таким образом протомер, спинин, стабилен в этих условиях и повторно объединяется при охлаждении с образованием двух различных нитевидных полимерных структур, которые различаются по своей стабильности, конформации белка и характеристикам реассоциации.
 WikiMatrix Он также противопоказан ВИЧ-инфицированным пациентам, принимающим ингибиторы протеазы, делавирдин и эфавиренц (который также является агонистом протомера рецептора 5HT2A-mGlu2 и увеличивает вероятность галлюцинаций у пациента во время терапии метилэргометрином).
WikiMatrix Он также противопоказан ВИЧ-инфицированным пациентам, принимающим ингибиторы протеазы, делавирдин и эфавиренц (который также является агонистом протомера рецептора 5HT2A-mGlu2 и увеличивает вероятность галлюцинаций у пациента во время терапии метилэргометрином). 
 WikiMatrix Ядро этого β-цилиндра окружает активный сайт в каждом протомере фермента.
WikiMatrix Ядро этого β-цилиндра окружает активный сайт в каждом протомере фермента. 
 WikiMatrixAllosteric белки являются олигомерными (состоящими из идентичных субъединиц протомера), и каждый протомер имеет рецептор для каждого из лигандов.
WikiMatrixAllosteric белки являются олигомерными (состоящими из идентичных субъединиц протомера), и каждый протомер имеет рецептор для каждого из лигандов.
 Giga-fren Межпротомерное сшивание Hsp80 с DMA и DMS подавлялось АТФ и в меньшей степени АДФ, ЦТФ и НАД.
Giga-fren Межпротомерное сшивание Hsp80 с DMA и DMS подавлялось АТФ и в меньшей степени АДФ, ЦТФ и НАД. 
 WikiMatrix Хотя одна молекула аксина содержит только один мотив рекрутирования β-катенина, его партнер, белок Adenomatous Polyposis Coli (APC), содержит 11 таких мотивов в тандемном расположении на протомер, таким образом, способный взаимодействовать с несколькими молекулами β-катенина одновременно.
WikiMatrix Хотя одна молекула аксина содержит только один мотив рекрутирования β-катенина, его партнер, белок Adenomatous Polyposis Coli (APC), содержит 11 таких мотивов в тандемном расположении на протомер, таким образом, способный взаимодействовать с несколькими молекулами β-катенина одновременно. 
 WikiMatrix Между 1499 и 1500 годами он доставил два больших трофея для размещения на высшем уровне палаццо, в то время как между 1493 и 1505 годами Каирано участвовал в изготовлении львиных протом, капителей, канделябров и фризов для того же высшего порядка.
WikiMatrix Между 1499 и 1500 годами он доставил два больших трофея для размещения на высшем уровне палаццо, в то время как между 1493 и 1505 годами Каирано участвовал в изготовлении львиных протом, капителей, канделябров и фризов для того же высшего порядка.
 WikiMatrix В структурной биологии протомер — это структурная единица олигомерного белка.
WikiMatrix В структурной биологии протомер — это структурная единица олигомерного белка. 
 WikiMatrix После диссоциации каждый протомер может принять расслабленное состояние, и этот согласованный ответ каждого протомера объясняет нелинейность активности фермента: молекула лиганда, которая стабилизирует расслабленное состояние одного из мономеров, не дает другим вернуться в ассоциированное состояние.
WikiMatrix После диссоциации каждый протомер может принять расслабленное состояние, и этот согласованный ответ каждого протомера объясняет нелинейность активности фермента: молекула лиганда, которая стабилизирует расслабленное состояние одного из мономеров, не дает другим вернуться в ассоциированное состояние. 
 WikiMatrix Протомеры обычно располагаются в циклической симметрии, образуя симметрии замкнутой точечной группы.
WikiMatrix Протомеры обычно располагаются в циклической симметрии, образуя симметрии замкнутой точечной группы.
 Полипептиды WikiMatrixVP2 и VP4 происходят от одного протомера, известного как VP0, который расщепляется с образованием различных компонентов капсида.
Полипептиды WikiMatrixVP2 и VP4 происходят от одного протомера, известного как VP0, который расщепляется с образованием различных компонентов капсида. 
 WikiMatrixЗападная база содержит еще одну часовню 4-го века до нашей эры, в центре которой стоит столица, увенчанная протомом-быком, которая сохранилась в Национальном музее Бейрута.
WikiMatrixЗападная база содержит еще одну часовню 4-го века до нашей эры, в центре которой стоит столица, увенчанная протомом-быком, которая сохранилась в Национальном музее Бейрута. 
 Giga-fren Высокая ионная сила вызывает сворачивание протомера, мультимерные ассоциации и, наконец, удлинение в зависимости от температуры.
Giga-fren Высокая ионная сила вызывает сворачивание протомера, мультимерные ассоциации и, наконец, удлинение в зависимости от температуры. 
 WikiMatrix Верхняя рама имела желоба с протомами в виде львов, а крыша была покрыта мраморной черепицей.
WikiMatrix Верхняя рама имела желоба с протомами в виде львов, а крыша была покрыта мраморной черепицей.
 патент-wipo Слои белка (1), регулярно повторяющиеся в двух измерениях, содержат протомеры белка (2), каждый из которых содержит по меньшей мере два мономера (5), (6), генетически слитых вместе.
патент-wipo Слои белка (1), регулярно повторяющиеся в двух измерениях, содержат протомеры белка (2), каждый из которых содержит по меньшей мере два мономера (5), (6), генетически слитых вместе. 
 Giga-fren Фермент, по-видимому, состоит из шести идентичных протомеров с молекулярной массой 81 000 каждый.
Giga-fren Фермент, по-видимому, состоит из шести идентичных протомеров с молекулярной массой 81 000 каждый. 
 WikiMatrix В исторической модели каждая аллостерическая единица, называемая протомером (обычно считается субъединицей), может существовать в двух различных конформационных состояниях — обозначенных ‘R’ (расслабленное) или ‘T’ (напряженное) состояния.
WikiMatrix В исторической модели каждая аллостерическая единица, называемая протомером (обычно считается субъединицей), может существовать в двух различных конформационных состояниях — обозначенных ‘R’ (расслабленное) или ‘T’ (напряженное) состояния.
 Giga-fren Таким образом, к попыткам использовать химическое поперечное сшивание как средство исследования сайтов контакта протомеров внутри больших олигомерных белков следует подходить с осторожностью.
Giga-fren Таким образом, к попыткам использовать химическое поперечное сшивание как средство исследования сайтов контакта протомеров внутри больших олигомерных белков следует подходить с осторожностью. 
 Springer Скорость перегруппировки определяется скоростью отрыва протона от одной из S-метильных групп, а также положением равновесия для протомации атома азота, на что указывают кинетические изотопные эффекты и влияние p -заместители соответственно.
Springer Скорость перегруппировки определяется скоростью отрыва протона от одной из S-метильных групп, а также положением равновесия для протомации атома азота, на что указывают кинетические изотопные эффекты и влияние p -заместители соответственно. 
 WikiMatrixВ период ориентализации такие треноги часто украшались фигурными протомами в форме грифонов, сфинксов и других фантастических существ.
WikiMatrixВ период ориентализации такие треноги часто украшались фигурными протомами в форме грифонов, сфинксов и других фантастических существ.
 WikiMatrix Он состоит из нескольких олигомерных структурных субъединиц, состоящих из белков, называемых протомерами.
WikiMatrix Он состоит из нескольких олигомерных структурных субъединиц, состоящих из белков, называемых протомерами. 
 WikiMatrix Поскольку он конкурентно противодействует эффектам ЛСД, его можно рассматривать как антагонист протомера гетеромера 5-HT2A-mGluR.
WikiMatrix Поскольку он конкурентно противодействует эффектам ЛСД, его можно рассматривать как антагонист протомера гетеромера 5-HT2A-mGluR.
Показаны страницы 1. Найдено 77 предложения с фразой protomers.Найдено за 6 мс.Накопители переводов создаются человеком, но выравниваются с помощью компьютера, что может вызвать ошибки. Найдено за 1 мс.Накопители переводов создаются человеком, но выравниваются с помощью компьютера, что может вызвать ошибки. Они поступают из многих источников и не проверяются. Имейте в виду.
.
