Тест по физике на тему «Основы Молекулярно-кинетической теории» 10 класс
ОСНОВЫ МКТ – 10 кл
Вариант 1
1. Масса газообразного водорода в сосуде равна 2г. Сколько примерно молекул водорода находится в сосуде?
А. 1023. Б. 2  1023. В. 6
1023. В. 6  1023. Г. 12
1023. Г. 12  1023. Д. среди ответов нет правильного.
1023. Д. среди ответов нет правильного.
2. Как изменится давление идеального газа при увеличении концентрации его молекул в 3 раза, если средняя квадратичная скорость молекул остаётся неизменной?
А. увеличится в 2 раза. Б. увеличится в 3 раза. В. не изменится. Г. уменьшится в 3 раза. Д. среди ответов нет правильного.
3. Как изменится средняя кинетическая энергия теплового движения молекул идеального газа при увеличении абсолютной температуры газа в 3 раза?
А. увеличится в 3 раза. Б. увеличится в 2 раза. В. увеличится в 4,5 раза. Г. увеличится в 9 раз. Д. среди ответов нет правильного.
4. В первом сосуде находится азот, во втором – водород. Чему равно отношение давления Р1 азота к давлению Р2 водорода при одинаковых значениях концентрации молекул и температуры?
А. 1. Б. 14. В. 1/14. Г. отношение Р1/Р2 может иметь различные значения. Д. среди ответов нет правильного.
5. Какое примерно значение температуры по шкале Цельсия соответствует температуре 200К по абсолютной шкале?
А. – 4730 С. Б. – 730 С. В. +730 С. Г. +4730 С. Д. среди ответов нет правильного.
6. Как изменится давление идеального газа при увеличении его объёма в 2 раза и уменьшении абсолютной температуры в 2 раза?
А. уменьшится в 2 раза. Б. уменьшится в 4 раза. В. не изменится. Г. увеличится в 2 раза. Д. увеличится в 4 раза.
7. Оцените приблизительно массу 1 м3 воздуха при нормальном атмосферном давлении и температуре 300К. Выберите из приведенных ниже значений наиболее близкое к полученному вами результату.
А. 1г. Б. 10г. В. 100г. Г. 1кг. Д. 10кг.
8. Как изменится внутренняя энергия идеального газа, если его давление и абсолютная температура увеличатся в 2 раза?
А. увеличится в 8 раз. Б. увеличится в 4 раза. В. увеличится в 2 раза. Г. не изменится. Д. среди ответов А – Г нет правильного.
9. Плотность газа в первом сосуде в 4 раза больше плотности того же газа во втором сосуде. Чему равно отношение средних квадратичных скоростей молекул газа в первом и втором сосудах, если давление газов одинаково?
А. 4. Б. 2. В. 1. Г. 1/2. Д. 1/4.
ОСНОВЫ МКТ – 10 кл
Вариант 2
В сосуде находится 2 моль гелия. Сколько примерно атомов гелия в сосуде?
А. 1023. Б. 2  1023. В. 6
1023. В. 6  1023. Г. 12
1023. Г. 12  1023. Д. среди ответов нет правильного.
1023. Д. среди ответов нет правильного.
2. Как изменится давление идеального газа, если при неизменной концентрации средняя квадратичная скорость молекул увеличится в 3 раза?
А. увеличится в 9 раз. Б. увеличится в 6 раз. В. увеличится в 3 раза. Г. не изменится. Д. среди ответов нет правильного.
3. При нагревании идеального газа средняя квадратичная скорость теплового движения молекул увеличилась в 4 раза. Как изменилась при этом абсолютная температура газа?
А. увеличилась в 2 раза. Б. увеличилась в 4 раза. В. увеличилась в 6 раз. Г. увеличилась в 16 раз. Д. среди ответов нет правильного.
4. В двух сосудах одинакового объёма находятся разные газы при одинаковой температуре, в первом сосуде водород, во втором кислород. Чему равно отношение числа молекул водорода к числу молекул кислорода, если давление газов одинаково?
А. 1. Б. 16. В. 1/16. Г. Отношение может иметь различные значения. Д. среди ответов нет правильного.
5. Какое примерно значение температуры по шкале Цельсия соответствует температуре 100К по абсолютной шкале?
А. – 3730С. Б. – 1730С. В. + 1730С. Г. +3730С. Д. среди ответов нет правильного.
6. Как изменилась абсолютная температура идеального газа, если при уменьшении его объёма в 2 раза давление уменьшилось в 2 раза?
А. уменьшится в 2 раза. Б. уменьшится в 4 раза. В. Осталась неизменной. Г. увеличилась в 2 раза. Д. увеличилась в 4 раза.
7. Оцените объём, занимаемый газообразным водородом при температуре 00С и давлении 105 Па, если масса водорода равна 2кг. Выберите из приведенных ниже значений наиболее близкое к полученному вами результату.
А. 22 м3. Б. 220 м3. В. 2,2 м3. Г. 0,22 м3. Д. 22  10-3 м3.
10-3 м3.
8. Как изменится внутренняя энергия идеального газа, если его давление и объём увеличатся в 2 раза?
А. увеличится в 8 раз. Б. увеличится в 4 раза. В. увеличится в 2 раза. Г. не изменится. Д. среди ответов нет правильного.
9. Чему примерно равно отношение средних квадратичных значений скоростей молекул водорода и кислорода при одинаковых значениях температуры газа?
А. 16. Б. 4. В. 1. Г. 1/4. Д. 1/16.
ОСНОВЫ МКТ – 10 кл
Вариант 3
Масса газообразного гелия в сосуде равна 4 г. Сколько примерно атомов гелия находится в сосуде?
А. 1023. Б. 4  1023. В. 6
1023. В. 6  1023. Г. 12
1023. Г. 12  1023. 1023. Д. 2 4
1023. 1023. Д. 2 4  1023.
1023.
2. Как изменится давление идеального газа, если при неизменной концентрации средняя кинетическая энергия молекул увеличится в 3 раза?
А. увеличится в 9 раз. Б. увеличится в 6 раз. В. увеличится в 3 раза. Г. останется неизменным. Д. среди ответов нет правильного.
3. При нагревании идеального газа средняя кинетическая энергия теплового движения молекул увеличилась в 2 раза. Как изменилась при этом абсолютная температура газа?
А. увеличилась в 4 раза. Б. увеличилась в 2 раза. В. увеличилась в 3 раза. Г. увеличилась в 4,5 раза. Д. среди ответов нет правильного.
4. В одном сосуде находится гелий, в другом – водород; концентрация молекул газов в сосудах одинакова. Какое из приведённых ниже соотношений для температуры гелия Т1 и водорода Т2 справедливо, если давления газов одинаковы?
А. Т1 < Т2. Б. Т1 > Т2. В. Т1 = Т2. Г. возможны все случаи А – В. Д. ни один из ответов не является правильным.
5. Какое примерно значение температуры по шкале Цельсия соответствует температуре 300К по абсолютной шкале?
А. – 5730С. Б. – 270С. В. + 270С. Г. + 5730С. Д. среди ответов А – Г нет правильного.
6. Как изменится объём идеального газа при уменьшении его давления в 2 раза и увеличении абсолютной температуры в 2 раза?
А. уменьшится в 2 раза. Б. уменьшится в 4 раза. В. Осталась неизменным. Г. увеличится в 2 раза. Д. увеличится в 4 раза.
7. Оцените давление газообразного кислорода в сосуде объёмом 22  10-3м-3 при температуре 00С, если масса кислорода в сосуде равна 32 г. выберите из приведённых ниже значений наиболее близкое к полученному вами результату.
10-3м-3 при температуре 00С, если масса кислорода в сосуде равна 32 г. выберите из приведённых ниже значений наиболее близкое к полученному вами результату.
А. 10 Па. Б. 100 Па. В. 103 Па. Г. 104 Па. Д. 105 Па.
8. Как изменится внутренняя энергия идеального газа, если его объём увеличится в 2 раза, а температура останется неизменной?
А. увеличится в 4 раза. Б. увеличится в 2 раза. В. уменьшится в 2 раза. Г. не изменится. Д. среди ответов А – Г нет правильного.
9. Средняя квадратичная скорость молекул газа в первом сосуде в 2 раза больше средней квадратичной скорости молекул того же газа во втором сосуде. Чему равно отношение плотности газа в первом и во втором сосудах, если давление газов одинаково?
А. 4. Б. 2. В. 1. Г. 1/2. Д. 1/4.
ОСНОВЫ МКТ – 10 кл
Вариант 4
В сосуде находится 0,5 моль водорода. Сколько примерно молекул водорода в сосуде?
А. 0,5 1023. Б. 1023. В. 3
1023. Б. 1023. В. 3  1023. Г. 6
1023. Г. 6  1023. Д. среди ответов А – Г нет правильного.
1023. Д. среди ответов А – Г нет правильного.
2. Как изменится давление идеального газа, если при неизменной концентрации абсолютная температура газа увеличится в 3 раза?
А. увеличится в 9 раз. Б. увеличится в 6 раз. В. увеличится в 3 раза. Г. останется неизменным. Д. среди ответов А – Г нет правильного.
3. Как изменится средняя квадратичная скорость теплового движения молекул идеального газа при увеличении абсолютной температуры газа в 4 раза?
А. увеличилась в 2 раза. Б. увеличилась в 4 раза. В. увеличилась в 6 раза. Г. увеличилась в 16 раза. Д. среди ответов А – Г нет правильного.
4. В первом сосуде находится кислород, во втором – водород. Чему равно отношение давления кислорода к давлению водорода при одинаковых значениях концентрации молекул и температуры?
А. 16. Б. 1. В. 1/16. Г. 4. Д. 1 / 4.
5. Какое примерно значение температуры по шкале Цельсия соответствует температуре 400К по абсолютной шкале?
А. – 6730С. Б. – 1270С. В. + 1270С. Г. + 6730С. Д. среди ответов А – Г нет правильного.
6. Как изменится давление идеального газа при увеличении его объёма в 2 раза и увеличении абсолютной температуры в 2 раза?
А. уменьшится в 2 раза. Б. уменьшится в 4 раза. В. не изменится. Г. увеличится в 2 раза. Д. увеличится в 4 раза.
7. Оцените температуру газообразного гелия в сосуде, если его масса равна 4г, объём сосуда 22,4 10-3м3, давление гелия 105 Па. Выберите из приведённых ниже значений наиболее близкое к полученному вами результату.
10-3м3, давление гелия 105 Па. Выберите из приведённых ниже значений наиболее близкое к полученному вами результату.
А. 3 К. Б. 30 К. В. 300 К. Г. 3000 К. Д. 30 000К
8. Как изменится внутренняя энергия идеального газа, если его давление увеличится в 2 раза, а объём уменьшится в 2 раза?
А. увеличится в 4 раза. Б. увеличится в 2 раза. В. останется неизменной. Г. уменьшится в 2 раза. Д. среди ответов А – Г нет правильного.
9. Чему примерно равно отношение абсолютных температур водорода и кислорода, если средние квадратичные скорости молекул этих газов одинаковы?
А. 16. Б. 4. В. 1. Г. 1/4. Д. 1/16.
2
3
4
5
6
7
8
9
В 1
Г
А
В
Д
В
Г
Г
А
Б
В 2
А
В
А
Д
Б
А
В
Г
Г
В 3
Г
Б
Г
Д
Г
Б
Б
В
А
В 4
В
Г
А
А
Г
Г
Б
Б
А
Тест по физике (10 класс) по теме: тест основы МКТ
Тест 1. Основные положения молекулярно-кинетической теории
I вариант
1. Невозможно бесконечно делить вещество на все более мелкие части. Каким из приведенных ниже положений можно объяснить этот факт?
А. все тела состоят из частиц конечного размера
Б. частицы вещества находятся в непрерывном хаотическом движении
В. давление газа обусловлено ударами молекул
Г. между частицами вещества существуют силы притяжения и отталкивания
2. Броуновским движением является
А. беспорядочное движение мелких пылинок в воздухе
Б. беспорядочное движение мошек, роящихся вечером под фонарем
В. проникновение питательных веществ из почвы в корни растений
Г. растворение твердых веществ в жидкостях
3. На рисунке показаны положения броуновской частицы в жидкости с интервалом 30 с, которые наблюдались в препарате. Изменение направления перемещения частицы в точке 2 произошло вследствие изменения
А. направления конвективных потоков жидкости
Б. сил поверхностного натяжения
В. вязкости жидкости
Г. равнодействующей сил действия молекул жидкости на частицу
4. Какая из приведенных ниже величин соответствует порядку значения массы молекулы или соединения?
А. 1027 кг Б. 10-27 кг
В. 1010 кг Г. 10-10 кг
5. Плотность железа примерно в 3 раза больше плотности алюминия. В алюминии количеством вещества 1 моль содержится атомов. В железе, количеством вещества 1 моль содержится атомов. Можно утверждать, что
А. Б.
В. Г.
6. Из контейнера с твердым литием изъяли 4 моль этого вещества. При этом число атомов лития в контейнере уменьшилось на
А. Б.
В. Г.
7. Сколько молекул содержится в 56 г азота?
А. 0 Б.
В. Г.
8. Какое количество вещества содержится в алюминиевой отливке массой 2,7 кг?
А. 0,1 моль Б. 10-4 моль
В. 100 моль Г. 100 кг
9. Найдите массу молекулы азота
А. 2,8∙10-26 кг Б. 4,7∙10-26 кг
В. 5,6∙10-26 кг Г. 9,4∙10-26 кг
10. Укажите пару веществ, скорость диффузии которых наибольшая при прочих равных условиях:
А. раствор медного купороса и вода
Б. пары эфира и воздух
В. свинцовая и медная пластины
Г. вода и спирт
Тест 1. Основные положения молекулярно-кинетической теории
II вариант
1. Чем обусловлено броуновское движение?
А. столкновением молекул жидкости (или газа) друг с другом
Б. столкновением частиц, взвешенных в жидкости (или газе)
В. столкновением молекул жидкости (или газа) с частицами, взвешенными в ней (нем)
Г. Ни одной из указанных причин
2. Хаотичность теплового движения молекул газа приводит к тому, что
А. плотность газа одинакова в любой точке занимаемого им сосуда
Б. плотность вещества в газообразном состоянии меньше плотности этого вещества в жидком состоянии
В. газ гораздо легче сжать, чем жидкость
Г. при одновременном охлаждении и сжатии газ превращается в жидкость
3. Броуновская частица переместилась за промежуток времени на расстояние . В этот промежуток времени она
А. двигалась прямолинейно с постоянной скоростью
Б. двигалась прямолинейно с постоянным ускорением
В. гармонически колебалась с амплитудой и периодом
Г. могла двигаться по какому угодно закону
4. Какая из приведенных ниже величин соответствует порядку линейных размеров молекул веществ?
А. 1027 м Б. 10-27 м
В. 1010 м Г. 10-10 м
5. В сосуде находится смесь двух газов: молекул кислорода и молекул водорода. Каково отношение количеств вещества этих газов?
А. 1 Б. 8
В. Г. 4
6. В баллоне находится газ, количество вещества которого равно 4 моль. Сколько (примерно) молекул газа находится в баллоне?
А. Б.
В. Г.
7. Определите число молекул, содержащихся в 64 г кислорода.
А. 3∙1023 Б. 6∙1023
В. 12∙1023; Г. 16∙1023;
8. Какое количество вещества содержится в алюминиевой ложке массы 27 г?
А. 1 моль Б. 2,5 моль
В. 5 моль Г. 10 моль
9. Найдите массу молекулы углекислого газа
А. 7,3∙10-26 кг Б. 6,9∙10-27 кг
В. 7,5∙10-26 кг Г. 8,3∙10-27 кг
10. В таблице представлен диаметр D пятна, наблюдаемого через промежуток времени t на мокрой пористой бумаге, лежащей на горизонтальном столе, после того как на нее капнули каплю концентрированного раствора красителя.
Какое явление стало причиной роста размеров пятна с течением времени?
А. растворение
Б. диффузия
В. распад красителя
Г. броуновское движение
Тест по физике Основы молекулярно-кинетической теории строения вещества 10 класс
Тест по физике Основы молекулярно-кинетической теории строения вещества 10 класс с ответами. Тест включает два варианта. В каждом варианте по 5 заданий.
Вариант 1
1. Какое количество вещества содержится в 360 г воды?
1) 20 моль
2) 18 моль
3) 0,02 моль
4) 18 ⋅ 10-3 моль
2. Постоянная Авогадро — это
1) число молекул или атомов в единице объёма
2) число молекул или атомов в 1 моль вещества
3) число молекул или атомов в теле
4) количество вещества в единице объёма
3. Сколько молекул содержится в капле воды массой 0,18 г?
1) 6,02 ⋅ 1025
2) 6,02 ⋅ 1021
3) 3,01 ⋅ 1023
4) 12 ⋅ 1023
4. Газы сжимаются значительно легче, чем жидкости или твёрдые тела, потому что
1) они состоят из более мелких и лёгких атомов и молекул
2) в газах между молекулами большие расстояния, а в жидкостях и твёрдых телах молекулы расположены вплотную друг к другу
3) молекулы газов легко сжимаются
4) при сближении молекулы газов притягиваются друг к другу, а молекулы твёрдых тел и жидкостей отталкиваются
5. Броуновское движение можно наблюдать
1) в жидкостях, газах и твёрдых телах
2) только в жидкостях и газах
3) только в жидкостях
4) только в газах
Вариант 2
1. Чему равна масса 10 моль воды?
1) 180 г
2) 18 ⋅ 10-2 г
3) 18 г
4) 18 кг
2. Постоянная Лошмидта — это
1) число молекул в 1 моль вещества
2) число молей в единице объёма
3) число молекул в теле
4) концентрация молекул
3. Какой объём занимают 25 моль алюминия?
1) 2,5 м3
2) 25 м3
3) 0,25 л
4) 25 л
4. При одинаковой температуре диффузия происходит
1) быстрее всего в газах
2) быстрее всего в жидкостях
3) быстрее всего в твёрдых телах
4) с одинаковой скоростью в газах, жидкостях и твёрдых телах
5. Молекулы вещества в твёрдом недеформированном теле находятся друг от друга на таких расстояниях, на которых
1) действуют только силы притяжения
2) действуют только силы отталкивания
3) силы притяжения уравновешиваются силами отталкивания
4) силы притяжения значительно превышают силы отталкивания
Ответы на тест по физике Основы молекулярно-кинетической теории строения вещества 10 класс
Вариант 1
1-1
2-2
3-2
4-2
5-2
Вариант 2
1-1
2-4
3-3
4-1
5-3
Тест по теме «Основы МКТ»
Физика
Вопрос 1
Как называется величина, характеризующая массу одного моля вещества?
молярная масса
масса моля
масса молекулы
масса вещества
Вопрос 2
Как называется раздел физики, который изучает физические свойства тел на основе рассмотрения их молекулярного строения?
Вопрос 3
Укажите, в каком из ответов наиболее полно представлены основные положения молекулярно-кинетической теории строения вещества:
— вещество состоит из маленьких частей и они заполняют пространство
— вещество состоит из мельчайших частиц и между ними действуют сил
затрудняюсь ответить
Вопрос 4
Какая единица измерения соответствует молярной массе?
кг
кг/моль
моль
1/моль
Вопрос 5
Какое определение соответствует физической величине «количество вещества»?
отношение числа молекул в данном теле к числу атомов в 0,012 кг углерода
масса вещества, взятого в количестве 1 моль
количество вещества, содержащее столько же молекул, сколько содержится атомов в 0,012 кг углерода
число молекул или атомов в 1 моле вещества
Вопрос 6
Диффузия происходит быстрее при повышении температуры вещества, потому что
увеличивается скорость движения частиц
увеличивается взаимодействие частиц
тело при нагревании расширяется
уменьшается скорость движения частиц
Вопрос 7
Молекулы вещества
только притягиваются друг к другу
только отталкиваются друг от друга
могут и притягиваться, и отталкиваться друг от друга
не взаимодействуют друг с другом
Вопрос 8
Газ называется идеальным, если:
взаимодействие между молекулами газа пренебрежимо мало
кинетическая энергия молекул много меньше потенциальной энергии
кинетическая энергия молекул много больше потенциальной энергии
похож на разряженный газ
Вопрос 9
Чем можно объяснить, что через некоторое время после открытия в комнате флакона с духами их запах ощущается по всему помещению?
Диффузией газов
Теплопроводностью стенок флакона
Духи могут действовать на рецепторы носа на расстоянии
Духи в открытом флаконе испускают излучение, улавливаемое рецепторами носа
Вопрос 10
Выберите неверное утверждение:
все вещества состоят из частиц;
между всеми частицами действуют гравитационные силы;
в любом агрегатном состоянии вещество не является сплошным;
силы притяжения между частицами вещества всегда меньше сил отталкивания.
Вопрос 11
Какие опыты доказывают существование хаотического теплового движения молекул?
Наблюдение диффузии веществ.
Наблюдение броуновского движения.
Непосредственное наблюдение движения молекул при помощи оптического микроскопа.
Первый и второй из описанных выше опытов.
Вопрос 12
Учитель записал на доске три утверждения, относящиеся к молекулам.
Размерами молекул можно пренебречь.
Молекулы при столкновениях взаимодействуют как упругие шары.
При любом расстоянии между молекулами между ними действуют силы притяжения.
Какие из этих утверждений можно соотнести с моделью идеального газа?
все три утверждения
только первое утверждение
первое и второе утверждения
первое и третье утверждения
Вопрос 13
При деформации твердого тела силы межмолекулярного взаимодействия
носят характер только притяжения
носят характер только отталкивания
носят характер притяжения или отталкивания — в зависимости от вида деформации
не возникают
Вопрос 14
Броуновское движение мелких частиц может наблюдаться
только в жидкостях
только в газах
только в жидкостях и в газах
в жидкостях, газах и в твёрдых телах
Вопрос 15
Какое из утверждений справедливо для газа?
Молекулы газа располагаются в строгом порядке
Газ сохраняет начальный объем
Характерное расстояние между молекулами газа по порядку величины совпадает с размерами самих молекул
Газ всегда занимает весь отведенный ему объем
Тест по физике «Основы молекулярно-кинетической теории»
Тест по теме «Основы молекулярно-кинетической теории»:
1) N(A) — это
а) число молекул
б) масса
в) число Авогадро
2) Как найти количество вещества?
а) N * N(A)
б) N/N(A)
в) 2N/N(A)
3) Что такое броуновское движение?
а) тепловое движение частиц
б) упорядоченное движение частиц
в) не движущиеся частицы
4) Что такое молекула?
а) система, состоящая из отдельных заряженных частиц
б) то, из чего состоит воздух
в) частица
5) Что создают многочисленные удары молекул о стенки сосуда?
а) давление жидкости
б) давление воздуха
в) ничего
6) Как называют беспорядочное движение молекул?
а) теплое движение
б) холодное движение
в) тепловое движение
7) Как называют тела, состоящие из множества молекул?
а) макроскопические
б) микроскопические
в) многомолекулярные
8) Из чего состоят вещества?
а) из атомов
б) из химических элементов
в) из частиц
9) Сколько утверждений лежат в основе молекулярно-кинетической теории?
а) 1
б) 2
в) 3
10) M(r) — что это?
а) масса
б) относительная молекулярная масса
в) объем
11) Кто впервые наблюдал явление движения частиц в 1827?
а) Броун
б) Браун
в) Эйнштейн
12) Кем была создана МКТ в 1905?
а) А. Эйнштейном
б) Р. Броуном
в) В. Скоттом
13) Что не сохраняет ни форму, ни объем?
а) жидкость
б) газ
в) твердое тело
14) Как найти молекулярную массу?
а) m(0) * N(A)
б) m(0) / N(A)
в) N(A) / m(0)
15) Кто внес большой вклад в МКТ?
а) Платон
б) Ньютон
в) Ломоносов
Тест по физике (10 класс) на тему: Интерактивный тест по теме «Основы молекулярно-кинетической теории идеального газа»
По теме: методические разработки, презентации и конспекты
 Тесты по теме «Молекулярно-кинетическая теория», 10 класс
Тесты по теме «Молекулярно-кинетическая теория», 10 класс
Представлено 10 блоков тестов по теме «МКТ» с ответами, физика 10 кл. В тестах охвачены все вопросы, касающиеся данной темы….
 Основное уравнение молекулярно-кинетической теории идеального газа
Основное уравнение молекулярно-кинетической теории идеального газа
Опорный конспект для подкотовки к итоговой аттестации по теме «Основное уравнение молекулярно-кинетической теории идеального газа»…
 Презентация ТЕСТ ТРЕНИРОВОЧНЫЙ ПО ТЕМЕ ОСНОВЫ МКТ ИДЕАЛЬНОГО ГАЗА
Презентация ТЕСТ ТРЕНИРОВОЧНЫЙ ПО ТЕМЕ ОСНОВЫ МКТ ИДЕАЛЬНОГО ГАЗА
ТЕС ПРЕДНАЗНАЧЕН ДЛЯ ПРОВЕРКИ ЗНАНИЙ ПО ТЕМЕ «ОСНОВЫ МКТ ИДЕАЛЬНОГО ГАЗА». ЭТО ИНТЕРАКТИВНЫЙ ТЕСТ. В НЁМ ЕСТЬ ССЫЛКИ НА ПОВТОРИТЕЛЬНЫЙ МАТЕРИАЛ, ЕСЛИ ОТВЕТ НЕВЕРНЫЙ….
 Информационная карта по физике. 10 класс. Идеальный газ. Основное уравнение молекулярно-кинетической теории.
Информационная карта по физике. 10 класс. Идеальный газ. Основное уравнение молекулярно-кинетической теории.
Информационная карта по физике для 10 класса вечерней школы по теме: «Идеальный газ.Основное уравнение молекулярно-кинетической теории»….
 Урок физики : «Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа.»
Урок физики : «Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа.»
План-конспект урока физики «Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа.»…
 Тест на закрепление темы Уравнение состояния идеального газа
Тест на закрепление темы Уравнение состояния идеального газа
Тест на закрепление темы Уравнение состояния идеального газа с код правильных ответов на 2 варианта….
 Контрольная работа «Основы молекулярно-кинетической теории идеального газа»
Контрольная работа «Основы молекулярно-кинетической теории идеального газа»
Контрольная работа «Основы молекулярно-кинетической теории идеального газа»…
Тест по теме «Основы МКТ»
Конкурсная работа «Тест по теме: Основы МКТ для 10 класса»
Учителя физики «Милютинской СШ» Житикаринского района
Костанайская область Абилевой Айжан Зейнеловны
Данный тест можно использовать после изучения тем : «Основные положения МКТ и её опытное подтверждение» , «Масса и размеры молекул» , «Термодинамические параметры.Температура и способы её измерения»
Список литературы:
1. «Физика» Б.Кронгарт В.Кем Н Койшыбаев издательство «Мектеп» Алматы 2006г.
2. «Биоэнергетика и биогазовые установки» презентация Скоринова Татьяна 10 «б» класс лицей 130 http://www.myshared.ru/slide/138910/ http://www.myshared.ru/slide/138910/
Инструкция к выполнению:
На выполнение теста даётся 25 минут
Оценивание по баллам 21-20 балл— высокий уровень
19-16 баллов— средний уровень от15 и ниже— достаточный уровень
Тест по теме: «Основы МКТ»
1. Из формулы m= m0 * N вывести новую формулу для m0
2.Назвать каждую величину: m m0 N
3.Какое из чисел является константой и играет важную роль в молекулярной физике, называют это число_____________
А. 6*1020 моль-1 Б. 6,06*1023 моль-1
В. 6,03*1022 моль-1 Г. 6,02*1023 моль-1
4.Допиши вторую часть формулы…
n= N\… m\M=… m0 * Nа =
М, V , ν,
5. М (Н2 О) =18*10-3 кг\моль что это за число…
А. молярная масса вещества Б. потенциальная масса вещества
В. атомная масса вещества Г. относительная молекулярная масса вещества
6.Массы молекул очень малы, в молекулярной физике их сравнивают с …
А.1\13 массы атома углерода Б. 1\13 массы атома водорода
В.1\12 массы атома водорода Г.1\12 массы атома углерода
7.Микрочастицы (атомы и молекулы) в теле движутся непрерывно и хаотично, чему примерно равна средняя скорость движения молекулы кислорода О2 при 00С:
А. 5 м\с Б. 25 м\с В. 100м\с Г. 425м\с
8.С чем связана скорость движения молекул или атомов:
А. Энергией кинетической Б. энергией потенциальной
В. температурой тела Г. массой тела
9. Какой температуре в 00С соответствует : 273К, 373К
А. 0 0С , 100 0С Б. 0 0С , 50 0С В. 00С , -100 0С Г. 00С , -150 0С
10. Биогаз — смесь газов. Его основные компоненты: метан СН4 углекислый газ СО2 , а также в малых количествах сероводород Н2 S азот NН3 водородН2 .Энергия, заключённая в 1м3 биогаза, эквивалентна энергии 0,6м3 природного газа, 0,74 л нефти, 0,65 л дизельного топлива, 0,48 л бензина. Рассчитайте относительную молекулярную массу газа…
Ответы:
1. m= m0 * N m0 = m\ N
2. масса вещества, масса одной молекулы, количество молекул
3. Г. 6,02*1023 моль-1 число Авогадро
4. n= N\ V m\M= ν m0 * Nа = М
5. А. молярная масса вещества
6. Г.1\12 массы атома углерода
7. Г. 425м\с
8. В. температурой тела
9. А. 0 0С , 100 0С
10. биогаз: СН4 =12+1*4=16 СО2 = 12+16*2 = 44
Н2 S = 1*2 + 32= 34 NН3 = 14+1*3=17 Н2 =1*2= 2
Мr = 16+44+34+17+2=113
9.5 Кинетико-молекулярная теория — химия 2e
Перейти к содержаниюХимия 2eХимия 2e9.5 Кинетико-молекулярная теория Классификация вещества
- Введение
- 2.1 Ранние идеи в атомной теории
- 2.2 Эволюция атомной теории
- 2.2 Эволюция
- 2.2.
- 2.3 Атомная структура и символика
- 2.4 Химические формулы
- 2.5 Периодическая таблица
- 2.6 Молекулярные и ионные соединения
- 2.7 Химическая номенклатура
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения 9000
Вещества и растворы
- Введение
- 3.1 Формула Масса и концепция молекулы
- 3.2 Определение эмпирических и молекулярных формул
- 3.3 Молярность
- 3.4 Другие единицы измерения концентраций растворов
- Ключевые термины
- Ключевые уравнения
- Сводка
- Упражнения
40004
40004
Химические реакции
- Введение
- 4.1 Написание и балансировка химических уравнений
- 4.2 Классификация химических реакций
- 4.3 Стехиометрия реакции
- 4.4 Выходы реакций
- 4.5 Количественный химический анализ
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение
- 5.1 Основы энергетики 5,3
- Введение
- 6.1 Электромагнитная энергия
- 6.2 Модель Бора
- 6.3 Развитие квантовой теории
- 6.4 Электронная структура атомов (электронные конфигурации)
- 6.5 Периодические изменения свойств элементов
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение
- 7.1 Ионная связь
- 7.2 Ковалентная связь
- 7.3 Символы и структуры Льюиса
- 7.4 Формальные заряды и резонанс
- 7.5 Сила ионных и ковалентных связей
- 7.6 Молекулярная структура и полярность
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
Ковалентное связывание
- Введение
- 8.1 Теория валентных связей
- 8.2 Гибридные атомные орбитали
- 8.3 Множественные связи
- 8.4 Молекулярная орбитальная теория
- Ключевые термины
- Ключевые уравнения
- Сводные данные
- Введение
- 9.1 Давление газа
- 9.2 Соотношение давления, объема, количества и температуры: закон идеального газа
- 9.3 Стехиометрия газообразных веществ, смесей и реакций
- 9.4 Истечение и диффузия газов
- 9.5 Кинетико-молекулярная теория
- 9.6 Неидеальное поведение газа
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение
- 10.1 Межмолекулярные силы
- 10.2 Свойства жидкостей
- 10.3 Фазовые переходы
- 10.4 Фазовые диаграммы
- 10.5 Твердое состояние вещества
- 10.6 Структуры решеток в кристаллических твердых телах
- Ключевые термины
- Ключевые уравнения
- Резюме
3 Решения
- Введение
- 11.1 Процесс растворения
- 11.2 Электролиты
- 11.3 Растворимость
- 11.4 Коллигативные свойства
- 11.5 Коллоиды
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение
- 12,1
.
10.7 Кинетическая молекулярная теория Кинетическая молекулярная теория. Кинетическая молекулярная теория. Кинетическая молекулярная теория. Кинетическая молекулярная теория
КИНЕТИЧЕСКАЯ МОЛЕКУЛЯРНАЯ ТЕОРИЯ ВЕЩЕСТВА

КИНЕТИЧЕСКАЯ МОЛЕКУЛЯРНАЯ ТЕОРИЯ ВЕЩЕСТВА Кинетико-молекулярная теория основана на идее, что частицы материи всегда находятся в движении.Теория может быть использована для объяснения свойств твердых тел, жидкостей,
Дополнительная информация
Межмолекулярные силы

Межмолекулярные силы: Введение Межмолекулярные силы Силы между отдельными молекулами и растворенными ионами (не связями) Ван-дер-Ваальсовы силы на 15% сильнее ковалентных или ионных связей Глава 11 Межмолекулярные
Дополнительная информация
CHEM 120 Online Глава 7

CHEM 120 Online Глава 7 Дата: 1.Какое из следующих утверждений не является частью кинетической молекулярной теории? А) Материя состоит из частиц, находящихся в постоянном движении. Б) Скорость частиц увеличивается
Дополнительная информация
Chem 112 Intermolecular Forces Chang Из книги (10, 12, 14, 16, 18, 20, 84, 92, 94, 102, 104, 108, 112, 114, 118 и 134)

Chem 112 Intermolecular Forces Chang Из книги (10, 12, 14, 16, 18, 20,84,92,94,102,104, 108, 112, 114, 118 и 134) 1.Атомы гелия не объединяются в молекулы He 2, что является наиболее привлекательным
Дополнительная информация
Глава 13 — ЖИДКОСТЬ И ТВЕРДЫЙ

Глава 13 — ЖИДКИЕ И ТВЕРДЫЕ ПРОБЛЕМЫ Задачи, которые стоит попробовать в конце главы: ответы в Приложении I: 1,3,5,7b, 9b, 15,17,23,25,29,31,33,45,49,51,53 , 61 13.1 Свойства жидкостей 1. Жидкости принимают форму своего контейнера,
Дополнительная информация
Химия 13: Состояния материи

Химия 13: Состояния материи Название: Период: Дата: Стандарт содержания химии: Газы и их свойства Кинетическая молекулярная теория описывает движение атомов и молекул и объясняет свойства
Дополнительная информация
Кинетическая теория газов

Кинетическая теория газов Физика 1425 Лекция 31 Майкл Фаулер, UVa Bernoulli’s Picture Даниэль Бернулли в 1738 году был первым, кто понял давление воздуха в терминах молекул, которые он визуализировал, стреляя
Дополнительная информация
Глава 12 — Жидкости и твердые тела

Глава 12 — Жидкости и твердые вещества 12-1 Жидкости I.Свойства жидкостей и кинетическая молекулярная теория A. Жидкости 1. Вещества, которые могут течь и, следовательно, принимать форму своего контейнера B. Относительный
Дополнительная информация
ОБЗОР КЛАССИЧЕСКОЙ КОНЦЕПЦИИ 8

ОБЗОР КЛАССИЧЕСКОЙ КОНЦЕПЦИИ 8 Кинетическая теория Информация, касающаяся начальных движений каждого из атомов макроскопических систем, недоступна, и у нас нет вычислительных возможностей даже с
.
Дополнительная информация
ХИМИЯ 113 ЭКЗАМЕН 4 (A)

Лето 2003 г. 1.Молекулярная геометрия иона PF 4 +: A. изогнутая B. тригональная плоская C. тетраэдрическая D. октаэдрическая ХИМИЯ 113 ПРИМЕР 4 (A) 2. Валентный угол Cl-C-Cl в молекуле CCl 2 O (C — центральный атом)
Дополнительная информация
Глава 10 Жидкости и твердые вещества

1 Глава 10 Жидкости и твердые вещества * 10.1 Полярные ковалентные связи и дипольные моменты — постоянная Ван-дер-Ваальса для воды (a = 5,28 л 2 атм / моль 2) по сравнению с O 2 (a = 1.36 л 2 атм / моль 2) — вода полярная (чертить диаграмму)
Дополнительная информация
ГЛАВА 10: МЕЖМОЛЕКУЛЯРНЫЕ СИЛЫ: УНИКАЛЬНОСТЬ ВОДЫ Проблемы: 10.2, 10.6, 10.15-10.33, 10.35-10.40, 10.56-10.60, 10.101-10.

ГЛАВА 10: МЕЖМОЛЕКУЛЯРНЫЕ СИЛЫ: УНИКАЛЬНОСТЬ ВОДЫ Проблемы: 10.2, 10.6,10.15-10.33, 10.35-10.40, 10.56-10.60, 10.101-10.102 10.1 ВЗАИМОДЕЙСТВИЕ МЕЖДУ ИОНАМИ Ион-ионные взаимодействия и энергия решетки
Дополнительная информация
МЕЖМОЛЕКУЛЯРНЫЕ СИЛЫ

МЕЖМОЛЕКУЛЯРНЫЕ СИЛЫ Межмолекулярные силы — силы притяжения и отталкивания между молекулами, которые удерживают молекулы, ионы и атомы вместе.Внутримолекулярные — силы химических связей внутри молекулы
Дополнительная информация
КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ

Глава 19: КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ 1. Доказательством того, что газ состоит в основном из пустого пространства, является тот факт, что: A. плотность газа становится намного больше, когда он сжижается B. газы оказывают давление
Дополнительная информация
Химия 1050 Глава 13 Жидкости и твердые вещества 1.Упражнения: 25, 27, 33, 39, 41, 43, 51, 53, 57, 61, 63, 67, 69, 71 (а), 73, 75, 79

Chemistry 1050 Глава 13 ЖИДКОСТЬ И ТВЕРДЫЕ 1 Текст: Петруччи, Харвуд, Сельдь, 8-е издание Предложите задачи по тексту Вопросы на повторение: 1, 5! 11, 13! 17, 19! 23 Упражнения: 25, 27, 33, 39, 41, 43 , 51, 53, 57,
Дополнительная информация
ИДЕАЛЬНЫЕ И НЕИДЕАЛЬНЫЕ ГАЗЫ

2/2016 идеальный газ 1/8 ИДЕАЛЬНЫЕ И НЕИДЕАЛЬНЫЕ ГАЗЫ НАЗНАЧЕНИЕ: Измерение того, как давление газа с низкой плотностью изменяется в зависимости от температуры, определение абсолютного нуля температуры путем линейной аппроксимации
Дополнительная информация
ГЛАВА 6 Химическая связь

ГЛАВА 6 Химическое связывание РАЗДЕЛ 1 Введение в химическое связывание ЦЕЛИ 1.Определите химическую связь. 2. Объясните, почему большинство атомов образуют химические связи. 3. Опишите ионную и ковалентную связь. 4. Объясните
.
Дополнительная информация
Межмолекулярные и ионные силы

Межмолекулярные и ионные силы Введение. Молекулы притягиваются друг к другу в жидком и твердом состояниях за счет межмолекулярных сил, или сил притяжения. Это достопримечательности, которые необходимо преодолеть
Дополнительная информация
Кинетическая теория и идеальный газ

1 из 6 Термодинамика Лето 2006 г. Кинетическая теория и идеальный газ Изучение термодинамики обычно начинается с понятий температуры и тепла, и большинство людей считает, что температура объекта
Дополнительная информация
Глава 4 Практическая викторина

Глава 4 Практический тест 1.Пометьте каждую коробку соответствующим состоянием вещества. A) I: газ II: жидкость III: твердое тело B) I: жидкость II: твердое вещество III: газ C) I: твердое вещество II: жидкость III: газ D) I: газ II: твердое вещество III:
Дополнительная информация
Глава 3 Чтение учащихся

Глава 3 Чтение учащихся Если вы держите в руке кусок твердого свинца или железа, он кажется тяжелым для своего размера. Если вы держите кусок бальзового дерева или пластика такого же размера, он кажется легким для своего размера.
Дополнительная информация
Калориметрия: теплота испарения

Калориметрия: теплота испарения ЦЕЛИ ВВЕДЕНИЕ — Узнайте, что подразумевается под теплотой испарения жидкости или твердого тела. — Обсудите связь между теплотой парообразования и межмолекулярной
Дополнительная информация
РАБОЧАЯ ТАБЛИЦА ЗАКОНА ХИМИИ

Закон Бойля Закон Чарльза Закона Гая-Лассака Комбинированный закон газа Для заданной массы газа при постоянной температуре объем газа изменяется обратно пропорционально давлению PV = k Объем фиксированной массы газа равен
Дополнительная информация
ИДЕАЛЬНЫЙ ГАЗОВЫЙ ЗАКОН И КИНЕТИЧЕСКАЯ ТЕОРИЯ

Глава 14 Закон идеального газа и кинетическая теория Глава 14 Закон идеального газа и обзор кинетической теории Кинетическая молекулярная теория включает в себя изучение вещества, особенно газов, как очень маленьких частиц с постоянной величиной
.
Дополнительная информация
Диффузия и поток жидкости

Диффузия и поток жидкости Что определяет коэффициент диффузии? Что определяет поток жидкости? 1.Распространение: Распространение относится к переносу вещества против градиента концентрации. ΔS> 0 Масса
Дополнительная информация
ГЛАВА 3: ВОПРОС. Вопросы для активного обучения: 1–6, 9, 13–14; Вопросы в конце главы: 1-18, 20, 24-32, 38-42, 44, 49-52, 55-56, 61-64

ГЛАВА 3: ВОПРОСЫ Активного обучения Вопросы: 1-6, 9, 13-14; Вопросы в конце главы: 1-18, 20, 24-32, 38-42, 44, 49-52, 55-56, 61-64 3.1 ВЕЩЕСТВО Материя: все, что имеет массу и занимает объем. Мы изучаем
.
Дополнительная информация
РЕКОМЕНДАЦИИ ПО ПОКАЗАНИЮ ОЦЕНКИ AP CHEMISTRY 2006

AP CHEMISTRY 2006 РУКОВОДСТВО ПО ОЦЕНКЕ ПОКАЗАТЕЛЯ Вопрос 6 6. Ответьте на каждый из следующих вопросов с точки зрения принципов молекулярного поведения и химических концепций. (а) Структуры глюкозы C 6 H 12 O 6 и циклогексана
Дополнительная информация
.
Кинетическая молекулярная теория вещества
Транскрипция
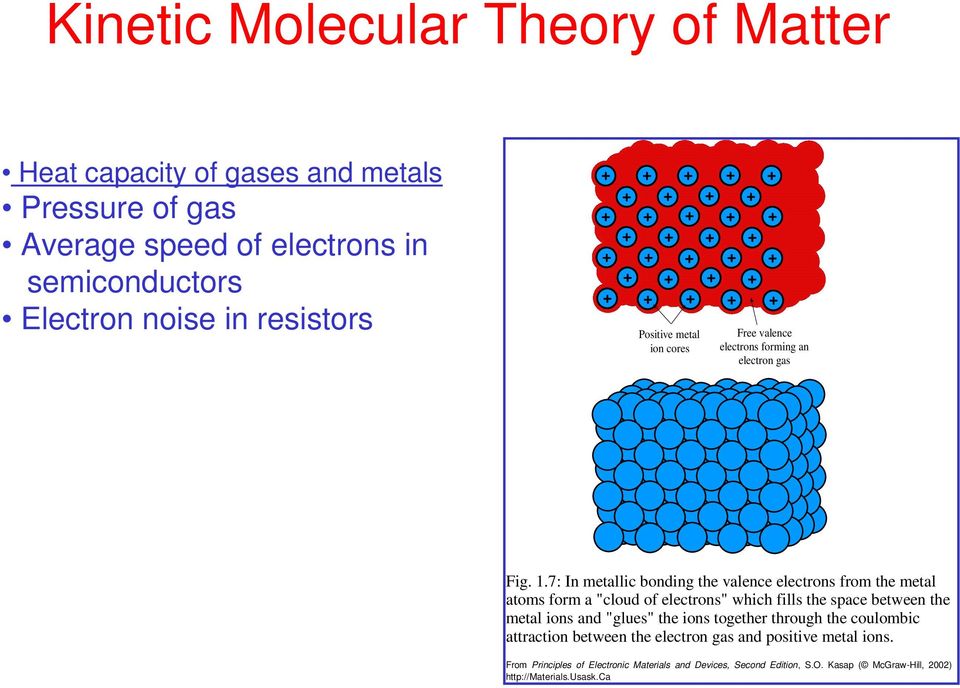
1 Кинетическая молекулярная теория вещества Теплоемкость газов и металлов Давление газа Средняя скорость электронов в полупроводниках Электронный шум в резисторах Сердечники с положительными ионами металлов Свободные валентные электроны, образующие электронный газ Рис..7: При металлической связи валентные электроны атомов металла образуют «облако электронов», которое заполняет пространство между ионами металлов и «склеивает» ионы вместе посредством кулоновского притяжения между электронным газом и положительными ионами металла. Из Принципов электронных материалов и устройств, второе издание, С.О. Kasap (McGraw-Hill, 00)
2 Апробация идеального газа.Давление Квадратный контейнер Микроскопическая модель Лицо B v Площадь A Сторона A a Давление (P) создается столкновениями молекул со стенками Атомы газа va Определение: P (давление) сила на единицу площади a Рис. 5: Молекулы газа в контейнер находятся в беспорядочном движении. Из Принципов электронных материалов и устройств, второе издание, С.О. Kasap (McGraw-Hill, 00) Наша задача — показать, что температура (T) связана со средней скоростью молекул. Допущения идеального газа :. молекулы находятся в постоянном и случайном движении, все направления эквивалентны.между молекулами нет взаимодействий, но есть столкновения 3. все столкновения упругие 4. размер молекул незначителен 5. Ньютоновская механика справедлива

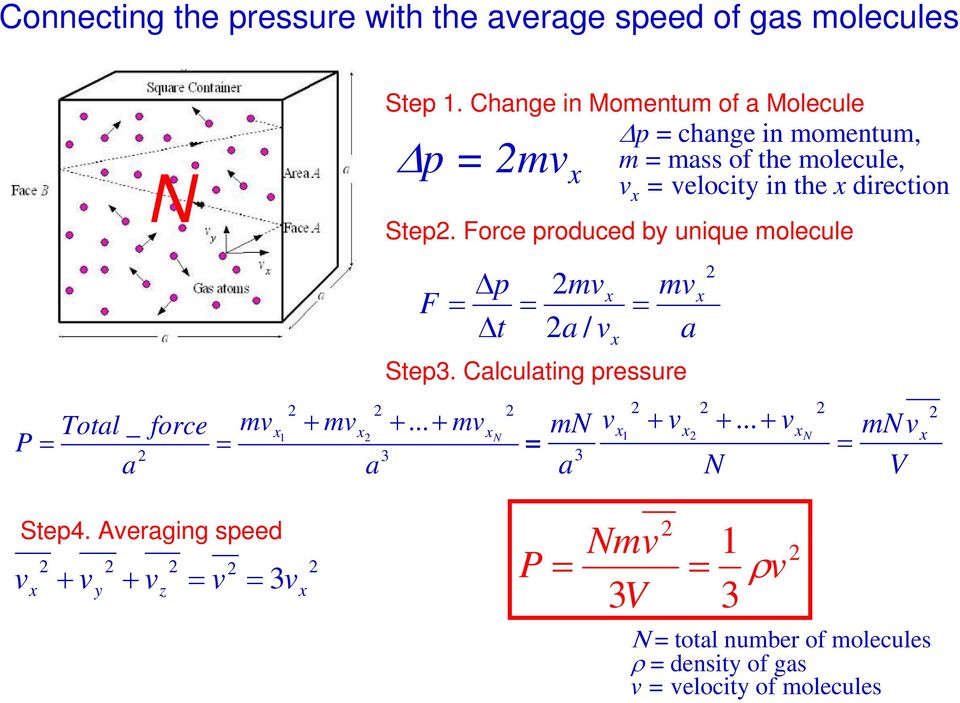
3 Связь давления со средней скоростью молекул газа N Шаг. Изменение количества движения молекулы Δp изменение количества движения, Δp m масса молекулы, v скорость в направлении Step. Сила, создаваемая b уникальной молекулой P Δp F Δt Total _ force… 3 a a N a / v mn 3 a v a Step3. Расчет давления v … v N N mnv V Шаг 4. Скорость усреднения v v v v 3v P N 3V ρv 3 Ν общее количество молекул ρ плотность газа v скорость молекул
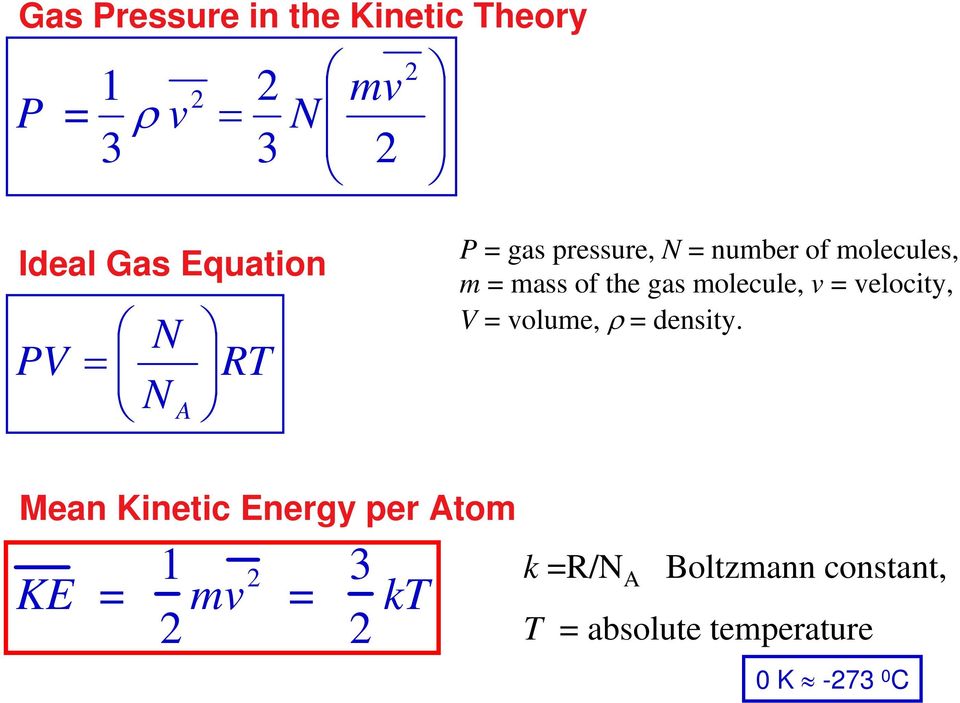
4 Давление Температура Объем Уравнение идеального газа PV N N A RT P — это давление, т.е. сила на единицу площади N — общее количество молекул в объеме V R — газовая постоянная (8.344 Дж моль — K -) N A — число Авогадро (моль -) Экспериментальный закон макроскопическая точка зрения

5 Давление газа в кинетической теории P ρ v 3 3 N m v Уравнение идеального газа PV N N A RT P давление газа, N количество молекул, m масса молекулы газа, v velocit, V volume, ρ densit. Средняя кинетическая энергия на атом KE 3 kt k R / N A Постоянная Больтмана, T абсолютная температура 0 K C
6 Газовая постоянная R Дж моль — K — постоянная Больтмана k ev K — R k N A R макроскопическая (техническая, термодинамическая и т. Д.)) расчеты k микроскопические (атомные) расчеты Мол (грамм молекулы) количество вещества, равное молекулярной массе вещества, выраженное в граммах Пример: Углерод имеет атомную массу моль углерода в граммах Моль содержит частицы (атомы, молекулы и др.) Н.А. и номер Авогадро

7 KE Внутренняя энергия на моль для одноатомного газа 3 кт UNA 3 N kt AU Общая внутренняя энергия на моль, NA Число Авогадроса, m Масса молекулы газа, k постоянная Больтмана, температура T Молярная теплоемкость при постоянном объеме C m du dt 3 N Ak 3 RC m удельная теплоемкость на моль при постоянном объеме (JK — моль -), общая внутренняя энергия U на моль, газовая постоянная R Определение: Тепловая емкость — это увеличение внутренней энергии на единицу температуры

Метод поглощения энергии с 8 степенями свободы (DF) Примеры: одноатомный газ имеет 3 DF. Двухатомный газ имеет 5 DF. Принцип равного распределения энергии по принципу Мавелла: каждый DF имеет среднюю энергию ½ kt. Одноатомный газ имеет 3 DF.E3 / kt C m 3 / R Двухатомный газ имеет 5 DF. E5 / kt C m 5 / R Твердые тела имеют 6 DF. E3kT C m 3 R (правило Дюлонга — Пети)

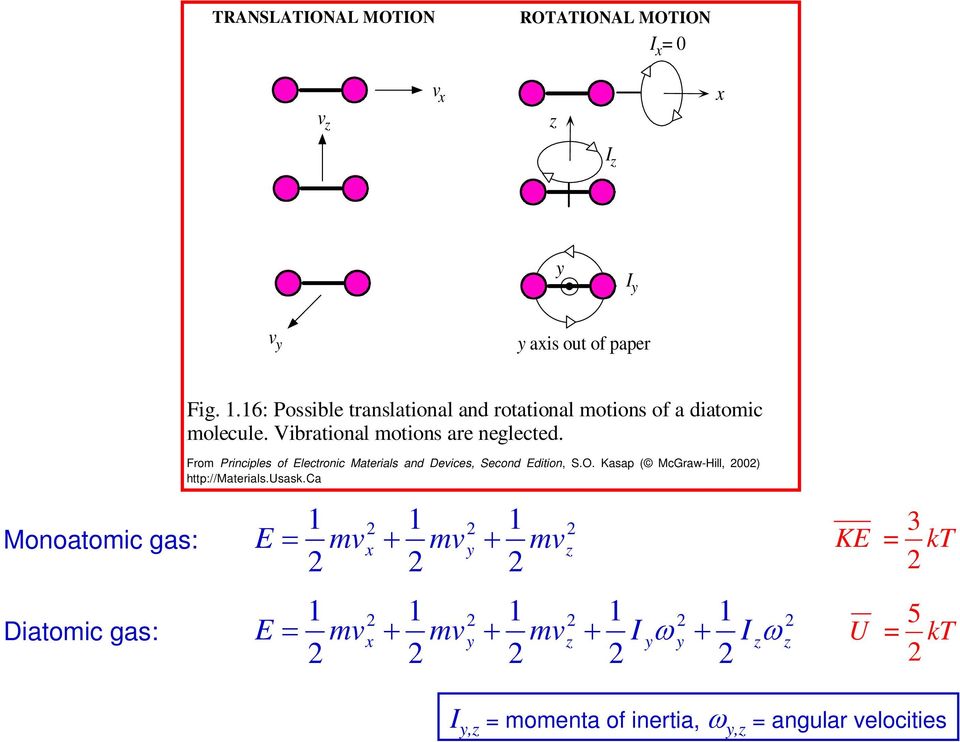
9 ТРАНСЛЯЦИОННОЕ ДВИЖЕНИЕ ВРАЩАТЕЛЬНОЕ ДВИЖЕНИЕ I 0 v v I I v ais out of paper Одноатомный газ: Двухатомный газ: Рис..6: Возможные поступательные и вращательные движения двухатомной молекулы. Колебательными движениями пренебрегают. Из Принципов электронных материалов и устройств, второе издание, С.О. Касап (McGraw-Hill, 00) E E I ω I ω KE U 3 5 узлов kt I, импульсы инерции, ω, угловые скорости
10 (a) E K K K K ,, жесткость пружины ,,, степени упругости пружин (b) Рис. 7 (a) Шарико-пружинная модель твердых тел, в которой пружины представляют собой межатомные связи. Каждый шар (атом) связан со своими соседями b пружинами. Атомные колебания в твердом теле включают 3 измерения.(б) Атом, колеблющийся около своего положения равновесия, растягивает и сжимает свои пружины к соседям и имеет как кинетическую, так и потенциальную энергию. 6 U kt 3kT Из принципов электронных материалов и устройств, второе издание, С.О. Kasap (McGraw-Hill, 00)
11 Dulong — Petit Rule U 3kT RN ak C m du dt 3R 5 J K- моль — C m удельная теплоемкость на моль при постоянном объеме (JK — моль -), общая внутренняя энергия U на моль, температура T, газовая постоянная R

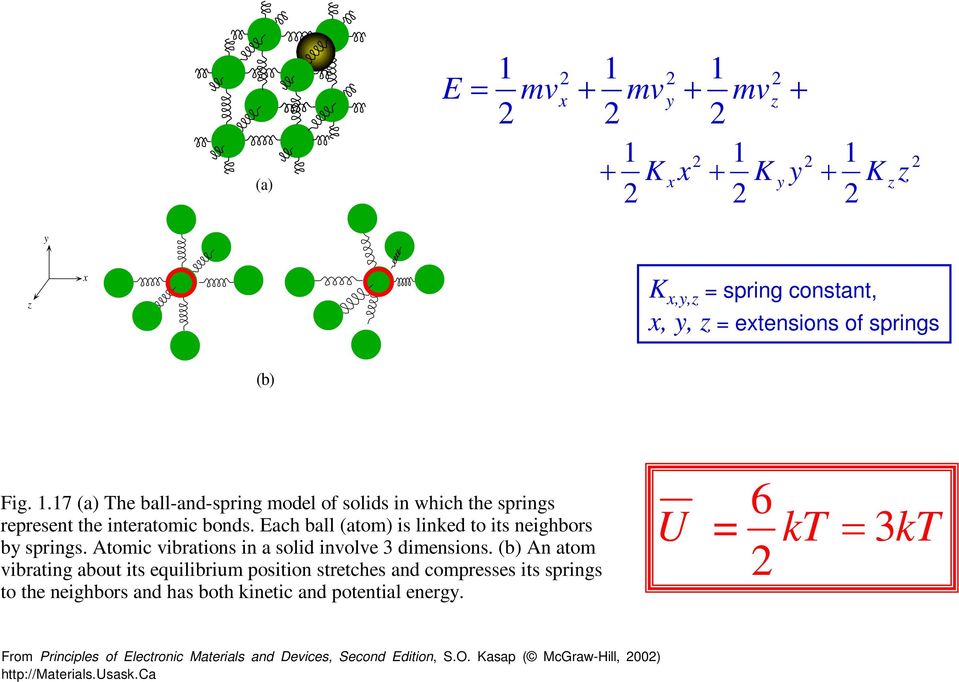
12 Каково распределение молекул по скоростям? Относительное количество молекул на единицу скорости (с / км) v * vav v rms 98 K (5 C) v * vav vrms 000 K (77 C) Скорость (м / с) 3 KE kt Рис..: Распределение Моуэлла-Больтмана молекулярных скоростей в газообразном азоте при двух температурах. Ордината dn / (ndv), дробное число молекул на единицу интервала скорости в (км / с) — From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (McGraw-Hill, 00)
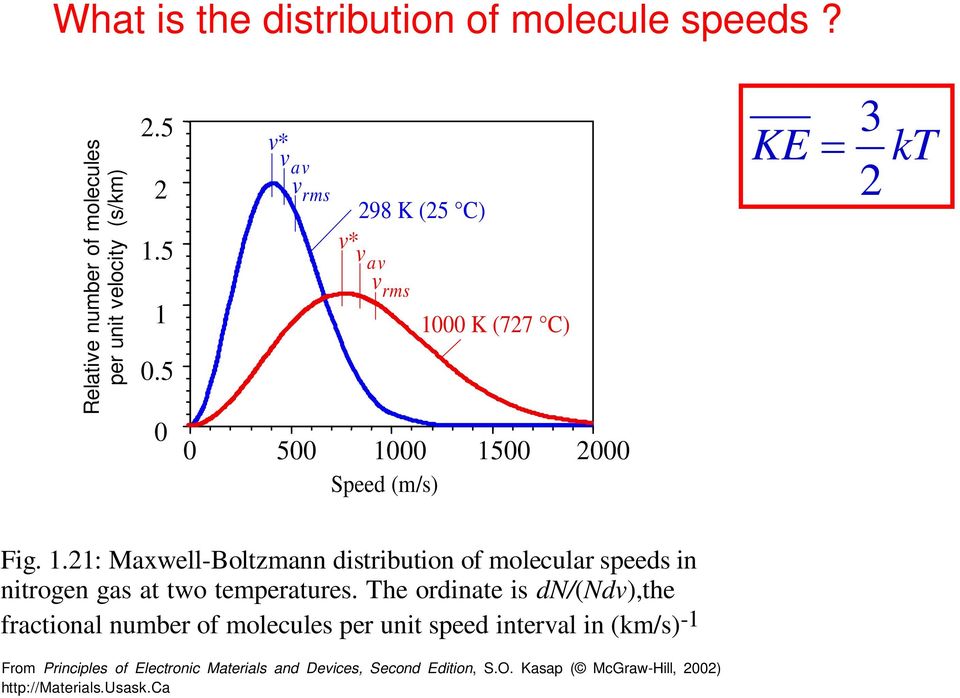
13 Как определить скорость молекулы?
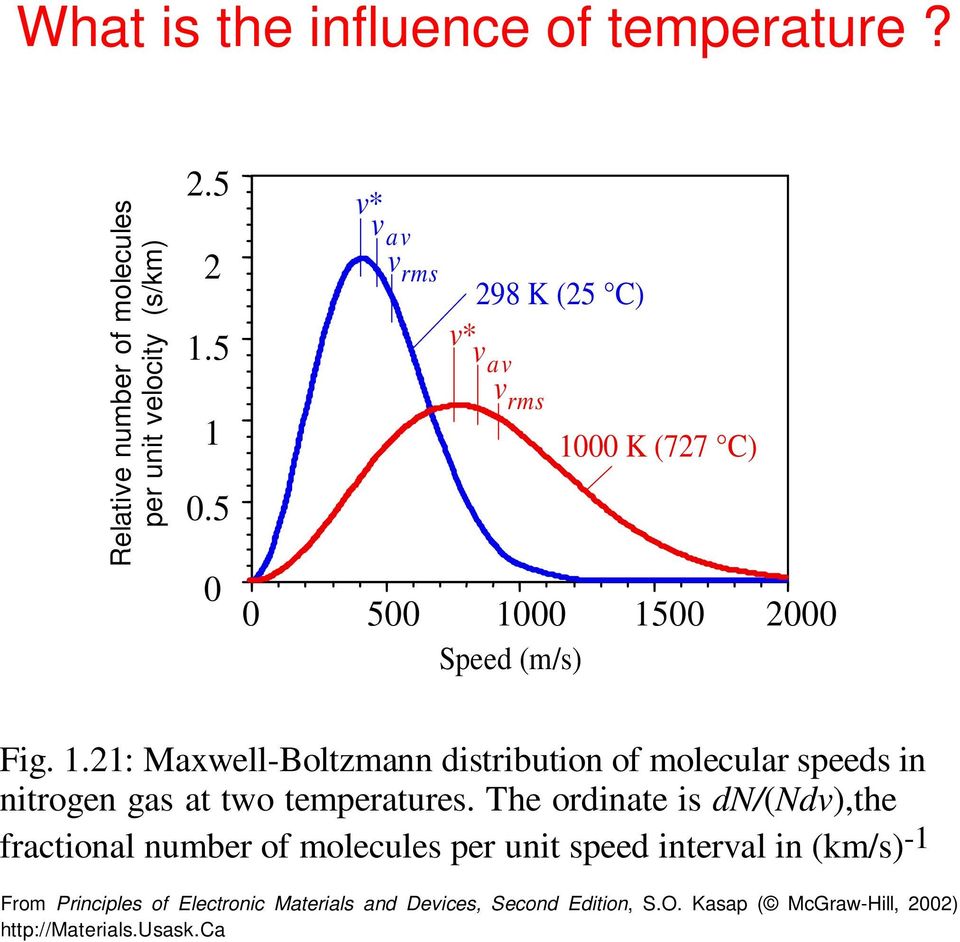
14 Как влияет температура? Относительное количество молекул на единицу скорости (с / км) v * vav v rms 98 K (5 C) v * vav vrms 000 K (77 C) Скорость (м / с) Рис..: Распределение Моуэлла-Больтмана молекулярных скоростей в газообразном азоте при двух температурах. Ордината dn / (ndv), дробное число молекул на единицу интервала скорости в (км / с) — From Principles of Electronic Materials and Devices, Second Edition, S.O. Kasap (McGraw-Hill, 00)
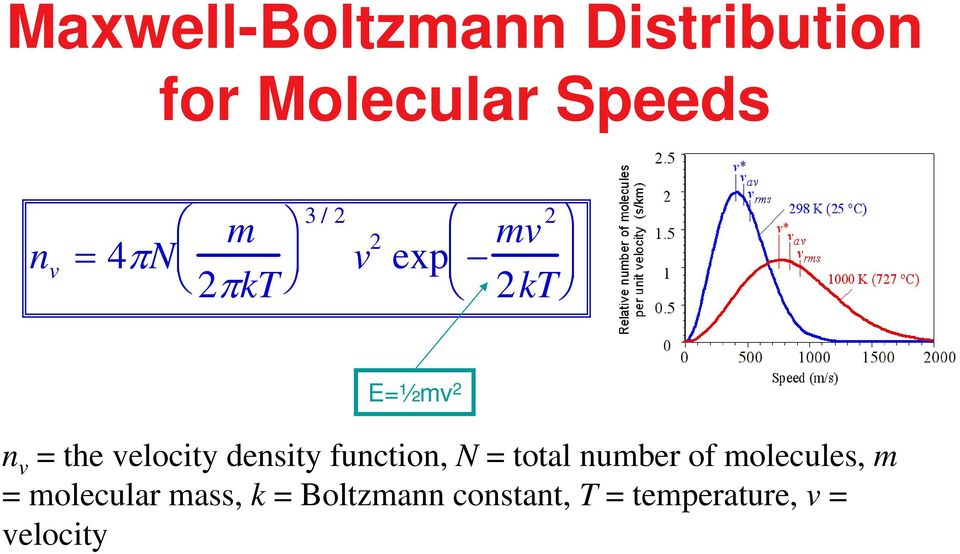
15 Распределение Моуэлла-Болтмана для молекулярных скоростей n v 4πN m πkt 3 / v ep kt n v функция плотности скорости, N общее количество молекул, m молекулярная масса, k постоянная Больтмана, T температура, v velocit
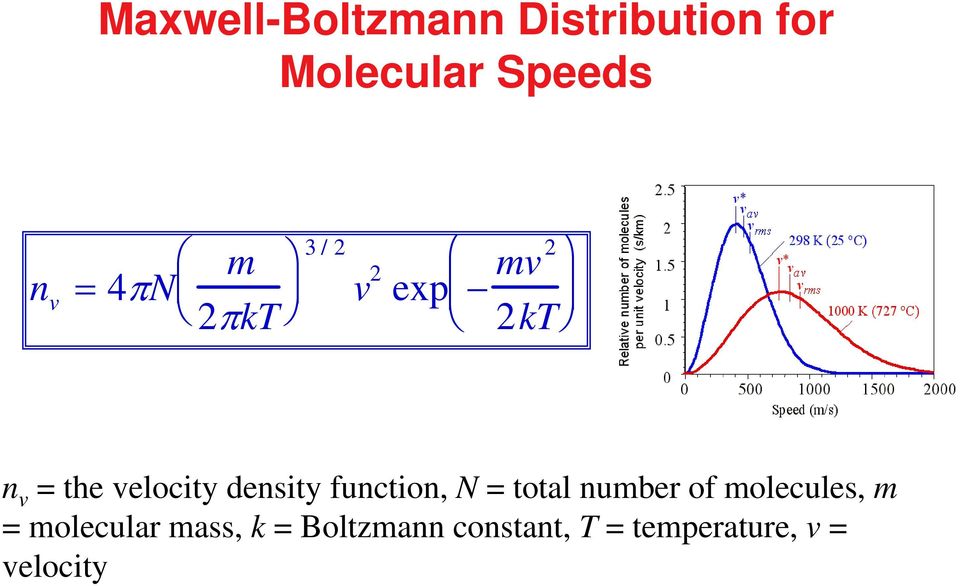
16 Распределение Моуэлла-Болтмана для молекулярных скоростей n v 4πN m πkt 3 / v ep kt E½ n v функция плотности скорости, N общее количество молекул, m молекулярная масса, k постоянная Больтмана, T температура, v velocit
17 Распределение Мауэлла-Болтмана для поступательной кинетической энергии n E π N kt 3 / E / ep E kt n E Число атомов в единице объема на единицу энергии при энергии E, N общее количество молекул в единице объема, k Постоянная Больтмана , Т температура.
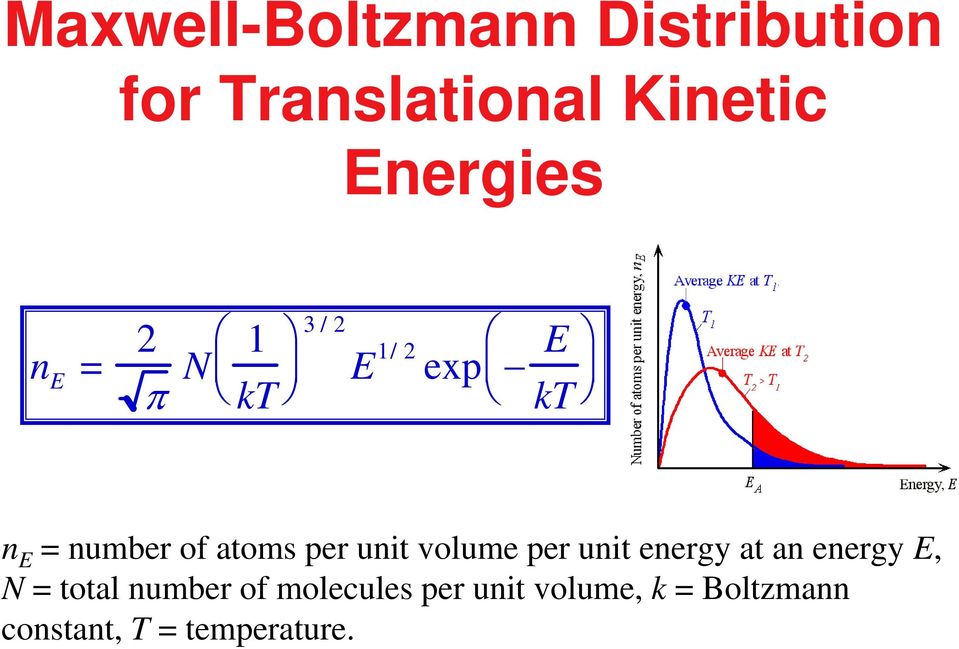
18 Boltmann Energ Distribution n ENEC ep kt n E Число атомов в единице объема на единицу энергии при энергии E, N общее количество атомов в единице объема в системе, C константа, которая зависит от конкретной системы, k Константа Больтмана , Т температура

19 Где находится средняя кинетическая энергия? Число атомов на единицу энергии, n E Среднее значение KE при T.T Среднее значение KE при T T> T E A Energ, E Рис.: Распределение энергии молекул газа при двух различных температурах. Число молекул, энергия которых превышает E A, обозначено заштрихованной областью. Эта область сильно зависит от температуры как ep (-e A / kt). Из Принципов электронных материалов и устройств, второе издание, С.О. Kasap (McGraw-Hill, 00)
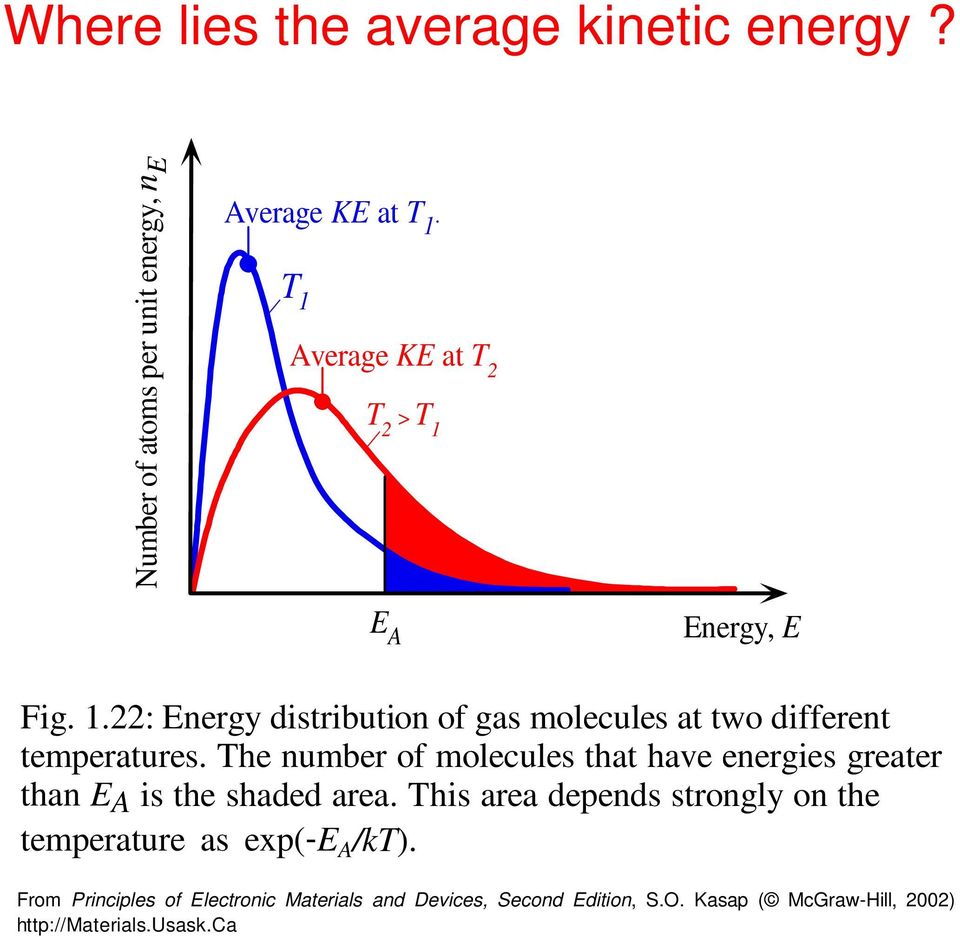
20 Что такое тепловое равновесие? E K K K ТВЕРДЫЙ ГАЗ E I ω I ω KE3 / kt M V v m Gas Atom KE3 / kt Рис..3: Твердое вещество, находящееся в равновесии на воздухе. Во время столкновений между атомами газа и твердого тела изменяется кинетическая энергия. Из Принципов электронных материалов и устройств, второе издание, С.О. Kasap (McGraw-Hill, 00)
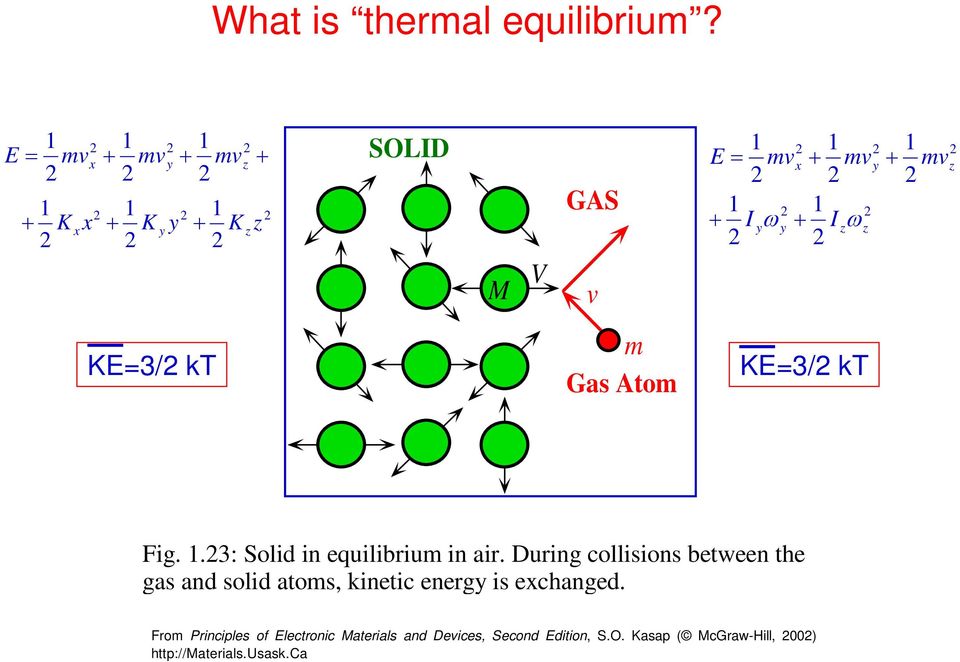
21 Что такое тепловое равновесие? SOLID KE3 / kt GAS MV vm Gas Atom KE3 / kt Количество тепла, переданное от кинетической энергии атомов в твердом теле к кинетической энергии молекул газа При равновесной теплопередаче 0
22 Механический шум Равновесное сжатие мм Δ 0 Δ <0 Компрессия Напряжение Δ Среднее смещение Δ 0 Мгновенная потенциальная энергия PE (t) ½K (Δ) Средняя потенциальная энергия Etension Δ> 0 ½K (Δ) ½kT м Рис..4: Колебания массы, прикрепленной к пружине из-за случайной бомбардировки молекулами воздуха Из Принципов электронных материалов и устройств, второе издание, С.О. Kasap (McGraw-Hill, 00) t (Δ) среднеквадратичное значение kt K K постоянная пружины, температура T, (Δ) среднеквадратичное значение колебаний массы относительно ее положения равновесия.
23 Электрический шум A B A B v 0 В v -3 мкВ A B Напряжение, v (t) v 5 мкВ Время Рис. 5. Случайное движение электронов проводимости в проводнике приводит к электрическому шуму.Из Принципов электронных материалов и устройств, второе издание, С.О. Kasap (McGraw-Hill, 00) Среднее значение 0 Средняя мощность?
24 Среднеквадратичное напряжение шума на сопротивлении R Поток электронов Ток электронного потока C Ток Рис..6: Зарядка и разрядка конденсатора b проводника из-за случайных тепловых движений электронов проводимости. Из Принципов электронных материалов и устройств, второе издание, С.О. Kasap (McGraw-Hill, 00) v (t) Время.Мгновенная энергия E (t) ½ C V (t). Средняя энергия E CV (t) kt 3. Среднеквадратичное напряжение kt V (t) C 4. Полоса пропускания B πrc V rms [4kTRB] / уравнение шума резистора Джонсона R сопротивление, ширина полосы B, среднеквадратичное значение напряжения шума, k Постоянная Больтмана , T температура
25 Среднеквадратичное шумовое напряжение на сопротивлении E (t) ½ CV (t) E CV (t) V (t) B kt C πrc kt Мгновенная энергия Средняя энергия и принцип равнораспределения среднеквадратичного напряжения Ширина полосы частот V rms [ 4kTRB] / уравнение шума резистора Джонсона R сопротивление, ширина полосы B, среднеквадратичное значение напряжения шума, k, постоянная Больтмана, температура T
,
