ПРОСТАЯ РЕАКЦИЯ — это… Что такое ПРОСТАЯ РЕАКЦИЯ?
- ПРОСТАЯ РЕАКЦИЯ
Большой психологический словарь. — М.: Прайм-ЕВРОЗНАК.
Под ред. Б.Г. Мещерякова, акад. В.П. Зинченко.
2003.
- ПРОПУСКНАЯ СПОСОБНОСТЬ (скорость переработки)
- ПРОСТРАНСТВО ОТВЕТСТВЕННОСТИ Я
Смотреть что такое «ПРОСТАЯ РЕАКЦИЯ» в других словарях:
простая реакция — paprastoji reakcija statusas T sritis chemija apibrėžtis Vienos pakopos reakcija. atitikmenys: angl. elementary reaction; one step reaction; simple reaction rus. одностадийная реакция; простая реакция; элементарная реакция ryšiai: sinonimas –… … Chemijos terminų aiškinamasis žodynas
простая реакция — paprastoji reakcija statusas T sritis fizika atitikmenys: angl. one step reaction; simple reaction vok. einstufige Reaktion, f rus. одностадийная реакция, f; простая реакция, f pranc. réaction simple, f … Fizikos terminų žodynas
простая реакция — paprastoji reakcija statusas T sritis Kūno kultūra ir sportas apibrėžtis Atsakas žinomu judesiu arba veiksmu į žinomą iš anksto signalą (pvz., teisėjo ženklas pradėti kovą). atitikmenys: angl. simple reaction; simple response vok. einfache… … Sporto terminų žodynas
РЕАКЦИЯ СОЕДИНЕНИЯ — РЕАКЦИЯ СОЕДИНЕНИЯ, химическая реакция, при которой два вещества соединяются с образованием третьего без каких либо побочных продуктов. Такие реакции весьма распространены в органической химии, в частности, добавляется простая молекула к двойной… … Научно-технический энциклопедический словарь
Простая жизнь (фильм) — У этого термина существуют и другие значения, см. Простая жизнь (значения). Простая жизнь / Няня Тао кант. трад. 桃姐 англ. A Simple Life / Sister Peach … Википедия
Реакция водителя — в автотехнической экспертизе дорожно транспортных происшествий учитывается реакция организма водителя транспортного средства на воздействие извне. Наиболее типичные Р.в.: простая и сложная реакция торможения на красный сигнал светофора, на… … Криминалистическая энциклопедия
СЕНСОМОТОРНАЯ РЕАКЦИЯ — одиночное дискретное движение оператора на появление (прекращение действия) того или иного раздражителя. Различают следующие виды С. р.: простая С. р., сложная С. р. и реакция на движущийся объект. В общем случае в С. р. различают четыре… … Энциклопедический словарь по психологии и педагогике
Обратимая реакция — Обратимые реакции химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), напр.: 3h3 + N2 ⇆ 2Nh4 Направление обратимых реакций зависит от концентраций веществ участников реакции. Так в приведённой… … Википедия
одностадийная реакция — paprastoji reakcija statusas T sritis chemija apibrėžtis Vienos pakopos reakcija. atitikmenys: angl. elementary reaction; one step reaction; simple reaction rus. одностадийная реакция; простая реакция; элементарная реакция ryšiai: sinonimas –… … Chemijos terminų aiškinamasis žodynas
элементарная реакция — paprastoji reakcija statusas T sritis chemija apibrėžtis Vienos pakopos reakcija. atitikmenys: angl. elementary reaction; one step reaction; simple reaction rus. одностадийная реакция; простая реакция; элементарная реакция ryšiai: sinonimas –… … Chemijos terminų aiškinamasis žodynas
Книги
- Мой отец зажигал звёзды, Меньщикова Татьяна. «Привет! Тут есть хоть кто-нибудь?»-взгляд Улитки упал на эту надпись, когда он сидел на ступенях подъезда. Сидел, обхватив колени, и чуть не плакал, а тут — такой легкомысленный привет… Подробнее Купить за 595 руб
- Мой отец зажигал звёзды, Меньщикова Татьяна. `Привет! Тут есть хоть кто-нибудь?`- взгляд Улитки упал на эту надпись, когда он сидел на ступенях подъезда. Сидел, обхватив колени, и чуть не плакал, а тут — такой легкомысленный привет… Подробнее Купить за 354 грн (только Украина)
- Кнопка Власти. Sex. Addict. Признания манипулятора, Виктория Исаева. История блестящего психологического мошенничества!Самые действенные и простые методы достижения целей, для успешного использования которых не обязательно быть магистром психологии!Что обычно… Подробнее Купить за 242 грн (только Украина)
Другие книги по запросу «ПРОСТАЯ РЕАКЦИЯ» >>
простые реакции — это… Что такое простые реакции?
- простые реакции
Простые реакции – химические реакции, протекающие в одну стадию.
Общая химия : учебник / А. В. Жолнин [1]
Общая химия : учебник .
А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина..
2012.
- произведение растворимости
- противоионы
Смотреть что такое «простые реакции» в других словарях:
Простые эфиры — Простые эфиры органические вещества, имеющие формулу R O R1, где R и R1 углеводородные радикалы. Следует однако учитывать, что такая группа может входить в состав других функциональных групп соединений, не являющихся простыми эфирами… … Википедия
РЕАКЦИИ В РАСТВОРАХ — хим. р ции, идущие между растворенными в вами, а также между растворенным в вом и р рителем. Как правило, р ритель принимает непосредств. участие в хим. взаимодействии. С одной стороны, р ритель проявляет себя как сплошная среда (континуум),… … Химическая энциклопедия
Время реакции — Время от момента раздражения рецепторов до начала рефлекторной реакции. * * * интервал времени от момента предъявления какого либо раздражителя до ответной реакции организма. Часть этого времени составляет латентный (скрытый) период. В. р.… … Энциклопедический словарь по психологии и педагогике
Эфиры простые — Простые эфиры органические вещества, имеющие формулу R O R1, где R и R1 углеводородные радикалы. Следует однако учитывать, что такая группа может входить в состав других функциональных групп соединений не являющихся простыми эфирами (см.… … Википедия
Эфиры простые — (хим.). Простыми Э. называются соединения спиртов между собой, происходящие путем выделения воды за счет водных остатков двух участвующих в реакции частиц спирта, которые могут быть одинаковы или различны, например: 2С2H5.ОН = (C2H5)2O + h3O, СН3 … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Химические реакции — Этим термином называется тот процесс, во время которого взятые тела превращаются в новые, ранее не существовавшие. В русском языке мы имеем два слова для выражения этого понятия: X. взаимодействие и X. превращение. Из них нужно отдать… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ХИМИЧЕСКИЕ РЕАКЦИИ — Равновесие. Вещества вступают в химические реакции потому, что при этом уменьшается энергия системы, т.е. электронная конфигурация продуктов реакции оказывается энергетически более выгодной, чем конфигурация исходных реагентов. (Правда, есть еще… … Энциклопедия Кольера
Ядерные реакции — превращения атомных ядер при взаимодействии с элементарными частицами, γ квантами или друг с другом. Для осуществления Я. р. необходимо сближение частиц (двух ядер, ядра и нуклона и т. д.) на расстояние Ядерные реакции 10 13 см. Энергия… … Большая советская энциклопедия
ОБРАТИМЫЕ РЕАКЦИИ — (равновесные), хим. реакции, к рые при одних условиях t°, давления и концентрации протекают в одном направлении, а при изменении этих условий в обратном направлении. В результате при данных условиях возникает состояние равновесия, т. е. в… … Большая медицинская энциклопедия
Время реакции выбора (choice reaction time) — В задаче на время простой реакции испытуемый лишь реагирует всякий раз, когда обнаруживает определенный раздражитель. Никакого решения помимо того, присутствует или отсутствует раздражитель, принимать не требуется. В задаче на В. р. в.… … Психологическая энциклопедия
Химические реакции: типы, свойства, уравнения
Характеристика химических реакций
Характеристика химических реакций
Химические реакции, их свойства, типы, условия протекания и прочая, являются одним из краеугольных столпов интересной науки под названием химия. Попробуем же разобрать что такое химическая реакция, и какова ее роль. Итак, химической реакцией в химии принято считать превращение одного либо нескольких веществ, в другие вещества. При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.
Химические реакции в природе и быту
Мы с вами окружены химическими реакциями, более того мы сами их регулярно осуществляем различными бытовыми действиями, когда например, зажигаем спичку. Особенно много химических реакций сами того не подозревая (а может и подозревая) делают повара, когда готовят еду.
Разумеется, и в природных условиях проходит множество химических реакций: извержение вулкана, фотосинтез листвы и деревьев, да что там говорить, практически любой биологический процесс можно отнести к примерам химических реакций.

Типы химических реакций
Все химические реакции можно условно разделить на простые и сложные. Простые химические реакции, в свою очередь, разделяются на:
- реакции соединения,
- реакции разложения,
- реакции замещения,
- реакции обмена.
Далее мы подробно остановимся на каждом из этих видов химических реакций, известных химии.
Химическая реакция соединения
По весьма меткому определению великого химика Д. И. Менделеева реакция соединения имеет место быть когда «их двух веществ происходит одно». Примером химической реакции соединения может быть нагревание порошков железа и серы, при которой из них образуется сульфид железа – Fe+S=FeS. Другим ярким примеров этой реакции является горение простых веществ, таких как сера или фосфор на воздухе (пожалуй, подобную реакцию можно также назвать тепловой химической реакцией).
Химическая реакция разложения
Тут все просто, реакция разложения является противоположностью реакции соединения. При ней из одного вещества получается два или более веществ. Простым примером химической реакции разложения может быть реакция разложение мела, в ходе которой из собственно мела образуется негашеная известь и углекислый газ.
Химическая реакция замещения
Реакция замещения осуществляется при взаимодействии простого вещества со сложным. Приведем пример химической реакции замещения: если опустить стальной гвоздь в раствор с медным купоросом, то в ходе этого простого химического опыта мы получим железный купорос (железо вытеснит медь из соли). Уравнение такой химической реакции будет выглядеть так:
Fe+CuSO4→ FeSO4+Cu
Химическая реакция обмена
Реакции обмена проходят исключительно между сложными химическими веществами, в ходе которых они меняются своими частями. Очень много таких реакций имеют место быть в различных растворах. Нейтрализация кислоты желчью – вот хороший пример химической реакции обмена.
NaOH+HCl→ NaCl+Н2О
Так выглядит химическое уравнение этой реакции, при ней ион водорода из соединения HCl обменивается ионом натрия из соединения NaOH. Следствием этой химической реакции является образование раствора поваренной соли.
Признаки химических реакций
По признакам протекания химических реакций можно судить прошла ли химическая реакция между реагентами или нет. Приведем примеры признаков химических реакций:
- Изменение цвета (светлое железо, к примеру, во влажном воздухе покрывается бурым налетом, как результат химической реакции взаимодействия железа и кислорода).
- Выпадение осадка (если вдруг через известковый раствор пропустить углекислый газ, то получим выпадение белого нерастворимого осадка карбоната кальция).
- Выделение газа (если Вы капнете на пищевую соду лимонной кислотой, то получите выделение углекислого газа).
- Образование слабодиссоциированных веществ (все реакции, в результате которых образуется вода).
- Свечение раствора (примером тут могут служить реакции, происходящие с раствором люминола, излучающего при химических реакциях свет).
В целом, трудно выделить какие признаки химических реакций являются основными, для разных веществ и разных реакций характерны свои признаки.
Как определить признак химической реакции
Определить признак химической реакции можно визуально (при изменении цвета, свечении), или по результатам этой самой реакции.
Скорость химической реакции
Под скоростью химической реакции обычно понимают изменение количества одного из реагирующих веществ за единицу времени. Притом, скорость химической реакции всегда положительная величина. В 1865 году химиком Н. Н. Бекетовым был сформулирован закон действия масс гласящий, что «скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам».
К факторам скорости химической реакции можно отнести:
- природу реагирующих веществ,
- наличие катализатора,
- температуру,
- давление,
- площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.
Равновесие химической реакции
Химическим равновесием называют такое состояние химической системы, при котором протекает несколько химических реакций и скорости в каждой паре прямой и обратной реакции равны между собой. Таким образом, выделяется константа равновесия химической реакции – это та величина, которая определяет для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия можно определить направление протекания химической реакции.
Условия возникновения химических реакций
Чтобы положить начало химических реакций, необходимо для этого создать соответствующие условия:
- приведение веществ в тесное соприкосновение.
- нагревание веществ до определенной температуры (температура химической реакции должна быть подходящей).
Тепловой эффект химической реакции
Так называют изменение внутренней энергии системы как результат протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
- единственно возможной работой при этом есть только лишь работа против внешнего давления.
- исходные вещества и продукты, полученные в результате химической реакции, имеют одинаковую температуру.
Химические реакции, видео
И в завершение интересно видео про самые удивительные химические реакции.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Reactions.
Урок 13. Типы химических реакций – HIMI4KA
В уроке 13 «Типы химических реакций» из курса «Химия для чайников» мы узнаем о типах химических реакций; подробно рассмотрим каждый тип и научимся их различать.


Мир химических реакций весьма разнообразен. Самые различные химические реакции постоянно происходят в природе, осуществляются человеком. Можно ли классифицировать химические реакции? Что положить в основу их классификации? Сущность всякой химической реакции состоит в превращении веществ: разрушаются исходные вещества и образуются продукты реакций, меняется число и состав исходных веществ и продуктов реакции. Характер этих изменений и положен в основу классификации химических реакций.
Реакции соединения
Рассмотрим уравнения следующих реакций (рис. 62):
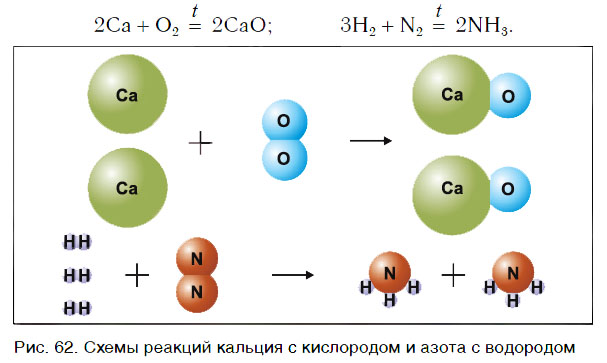

Чем сходны данные реакции между собой? Тем, что в результате взаимодействия двух веществ получается только одно вещество. Такие реакции получили название реакций соединения.
Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
В одних случаях из двух простых веществ получается одно сложное, в других — соединяются два и более простых или сложных веществ:
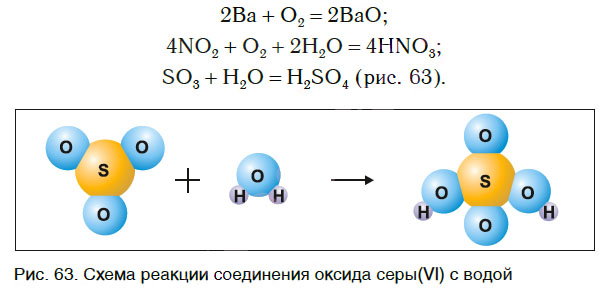

Реакции разложения
Рассмотрим уравнения следующих реакций:
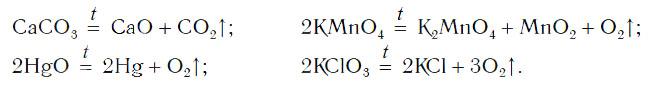
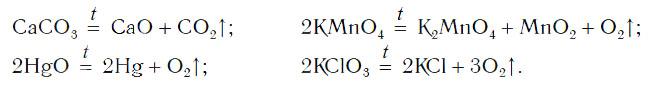
Можно заметить, что из одного сложного вещества получается два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
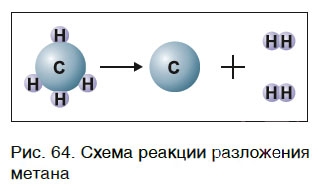
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, негашеную известь CaO в промышленности получают нагреванием известняка CaCO3, реакция разложения происходит при температуре около 1000 °С. К такому типу реакций относится и реакция разложения метана CH4 (рис. 64) — составной части природного газа:

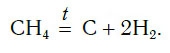
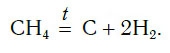
Реакции замещения
А могут ли взаимодействовать между собой два вещества: одно простое и одно сложное? Проверим это на опыте. В раствор медного купороса опустим небольшой кусочек железа — кнопку, гвоздь, канцелярскую скрепку с хорошо очищенной поверхностью. Через 2—3 мин извлечем железо из раствора и увидим, что на его поверхности образовался темно-красный налет меди. В химическую реакцию вступили простое (Fe) и сложное (CuSO4) вещества, и образовались новое простое (Cu) и новое сложное (FeSO4) вещества:
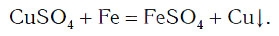
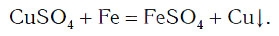
Из опыта и уравнения химической реакции хорошо видно, что атомы железа заместили атомы меди в сложном веществе (рис. 65). Такие химические реакции относятся к реакциям замещения.


Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Для протекания таких реакций необходимо соблюдать некоторые особые условия. Не все простые вещества обязательно должны взаимодействовать со сложными веществами. В дальнейшем при изучении химии вы познакомитесь с этими условиями, а также с другими типами химических реакций.
Краткие выводы урока:
- Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
- Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
- Реакции замещения — это реакции, в которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Надеюсь урок 13 «Типы химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Реакция простая — Справочник химика 21
Зависимость скорости реакции от температуры. Энергия активации. Для многих реакций, а особенно для реакций простых, фактор, учитывающий влияние температуры в кинетическом уравнении (УП1-8), или так называемая константа скорости реакции, может быть представлена с помощью уравнения Аррениуса [c.214]
Кинетически реакция Дильса-Альдера вполне, очевидно, является бимолекулярной, а обратная реакция — простым мономолекулярным разложением. Для изучения кинетики эта реакция представляет наилучший образец обратимой реакции, оба направления которой могут изучаться как в жидкой, так и в паровой фазах. Ее механизм стал предметом большой дискуссии, в ходе которой было высказано три точки зрения 1) это полярная реакция, включающая нуклеофильное присоединение диена к диенофилу, 2) она является реакцией, идущей через радикальный механизм, и 3) это есть практически молекулярный процесс, включающий электронную перегруппировку образующегося в качестве промежуточного соединения комплекса. [c.180]
Экспериментальное определение порядка реакции. Простые системы 73 [c.73]
Величина, обратная константе скорости мономолекулярной реакции (простой реакции первого порядка), характеризует среднюю продолжительность жизни отдельных молекул. Действительно, среднюю продолжительность жизни отдельной молекулы можно найти, если считать, что [c.22]
Наблюдаемая результирующая скорость обратимой химической реакции в том случае, когда прямая и обратная реакции — простые, может быть представлена зависимостью [c.211]
При равных значениях /оо, у, /Зг// и п величина I совершенно нечувствительна к значению п иными словами, влияние величины п в наибольшей степени учтено путем ее включения в -у -Определение у таково, что уравнение абсорбции режима быстрой реакции просто получится при [c.76]
Реакции конденсации можно использовать и для получения мелких молекул. При выполнении следующей лабораторной работы вы проведете реакцию конденсации и получите сложный эфир. Эта реакция — простой пример того, как из одних органических веществ можно получить другие. Сложные эфиры, получаемые похожими способами, входят в состав многих синтетических отдушек и душистых веществ. Такие же реакции, повторенные много раз, приводят к образованию полиэфиров. [c.222]
В части 1 Бенсон обстоятельно рассматривает математические закономерности протекания во времени реакций простых типов, а также усложнения, возникающие при рассмотрении обратимых, параллельных и последовательных реакций. Автор дает разнообразные приемы обработки кинетических данных, которые необходимо знать каждому экспериментатору. [c.6]
Однако при высоких давлениях озона эти смеси могут взрываться. Хотя с химической точки зрения эти реакции просты, они трудны для изучения, так как чрезвычайно чувствительны к катализу металлами, окисями металлов и следами примесей, таких, как органические вещества, перекиси или окислы азота. Последние две примеси практически трудно отделить, если кислород, подвергающийся озонированию, содержит следы N2 и Н2О. [c.347]
Вышеприведенная реакция просто и удовлетворительно объясняет процесс ингибирования окисления. Однако вполне вероятно, что ингиби-тирование не ограничивается только одной определенной реакцией, так, ингибирующее действие ароматических аминов основывается, возможно, и на одновременно происходящих побочных реакциях [9]. [c.295]
Имеется ряд патентов, описывающих особые условия реакции простейших олефинов с аммиаком с образованием нитрилов [36]. Рекомендуемые условия — температура около 340°, давление порядка 105,5— 210,9 кг см и присутствие различных катализаторов. Выходы нитрилов как правило, низкие, хотя пропилен и аммиак при указанных условиях [c.380]
Важным фактором, определяющим расчет, является тип реакции. Различаются следующие типы реакций простые параллельные последовательные сложные обратимые. [c.132]
Типы реакций. Простейшая реакция протекает по схеме А->Н Уравнение скорости такой реакции имеет вид [c.134]
В термохимии энтальпии простых веществ (Нг, Ог, Ств и другие) принимаются равными нулю. Тогда энтальпия образования соединения из простых веществ равна просто этой величине, так как энтальпии участвующих в реакции простых веществ равны нулю. Энтальпии веществ определяют экспериментально, путем измерения в термохимической бомбе. Эти же величины можно рассчитывать для химической реакции с помощью уравнения изобары химической реакции по равновесным данным или по данным электрохимических измерений при разных температурах. [c.65]
Наряду с реакциями, протекающими через последовательные стадии, необходимо различать также параллельные реакции. Простейшим типом параллельных реакций являются такие реакции, когда одно и то же исходное вещество А способно реагировать двумя или болсс независимыми путями, приводящими к одинаковым или различным продуктам реакции [c.16]
Колебательная релаксация (V—Т-обмен). Колебательная релаксация существенно влияет па кинетику химических реакций. Простейшим примером является релаксация системы гармонических осцилляторов в тепловом резервуаре. Исследование взаимодействия двухатомной молекулы, моделируемой гармоническим осциллятором, с молекулой теплового резервуара с температурой показывает (см. 15), что переходы происходят только между соседними колебательными уровнями со средними вероятностями [c.48]
По сложности химические реакции разбивают на простые и сложные реакции. Простыми химическими реакциями называют реакции, протекающие в одну стадию. Реакции, протекающие в несколько стадий, часто по нескольким направлениям, называют сложными реакциями. Каталитические, цепные, фотохимические и электрохимические реакции являются сложными реакциями, но выделяются в самостоятельные группы, так как каждая из них имеет свои специфические особенности. [c.531]
Если
Химические реакции, типы реакций, виды реакций, окислительно-восстановительные реакции
Виды реакций:Все химические реакции подразделяют на простые и сложные. Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Д. И. Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно. Примером химической реакции соединения может служить нагревание порошков железа и серы, — при этом образуется сульфид железа: Fe+S=FeS. К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода,…) на воздухе. Например, углерод горит на воздухе С+О2=СО2 (конечно эта реакция протекает постепенно, сначала образуется угарный газ СО). Реакции горения всегда сопровождаются выделением тепла — являются экзотермическими.
Химические реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число. Примером реакции разложение меже служить химическая реакция разложения мела (или известняка под воздействием температуры): СаСО3→ СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
В реакциях двух других типов число реагентов равно числу продуктов. Если взаимодействуют простое вещество и сложное —то эта химическая реакция называется химической реакцией замещения: Например опустив стальной гвоздь в раствор медного купороса получаем железный купорос (здесь железо вытеснило медь из её соли) Fe+CuSO4→ FeSO4+Cu.
Реакции между двумя сложными веществами, при которых они обмениваются своими частями, относят к химическим реакциям обмена. Большое их число протекает в водных растворах. Примером химической реакции обмена может служить нейтрализация кислоты щёлочью: NaOH+HCl→ NaCl+Н2О.
Здесь в реагентах (веществах, стоящих слева) ион водорода из соединения HCl обменивается с ионом натрия из соединения NaOH, в результате чего образуется раствор поваренной соли в воде
Типы реакций и их механизмы приведены в таблице:
|
химические реакции соединения
A + B = AB
Пример:
Из нескольких простых или сложных веществ образуется одно сложное
|
химические реакции разложения
AB = A + B
Пример:
Из сложного вещества образуется несколько простых или сложных веществ
|
химические реакции замещения
A + BC =AC + B
Пример:
Атом простого вещества замещает один из атомов сложного
|
химические реакции ионного обмена
AB+CD = AD+CB
Пример:
Сложные вещества обмениваются своими составными частями
|
Однако очень многие реакции не укладываются в приведённую простую схему. Например, химическая реакция между перманганатом калия (марганцовкой) и иодидом натрия не может быть отнесена ни к одному из указанных типов. Такие реакции, обычно, называют окислительно — восстановительные реакции, например:
2KMnO4+10NaI+8H2SO4→ 2MnSO4+K2SO4+5Na2SO4+5I2+8H2O.
Признаки химических реакций. По ним можно судить, прошла ли химическая реакция между реагентами или нет. К таким признакам принято относить следующие:
— Изменение цвета (например, светлое железо покрывается во влажном воздухе бурым налётом оксида железа — химическая реакция взаимодействия железа с кислородом).
— Выпадение осадка (например, если через известковый раствор (раствор гидроксида кальция) пропустить углекислый газ, выпадет белый нерастворимый осадок карбоната кальция).
— Выделение газа (например, если капнуть лимонной кислотой на пищевую соду, то выделится углекислый газ).
— Образование слабодиссоциированных веществ (например, реакции, при которых одним из продуктов реакции является вода).
— Свечение раствора.
Примером свечения раствора может служить реакция с использованием такого реагента как раствор люминола (люминол- это сложное химическое вещество, которое может излучать свет при химических реакциях).
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — составляют особый класс химических реакций. Их характерной особенностью является изменение степени окисления, по крайней мере, пары атомов: окисление одного (потеря электронов) и восстановление другого (присоединение электронов).
Сложные вещества, понижающие свою степень окисления — окислители, а повышающие степень окисления — восстановители. Например:
2Na + Cl2→ 2NaCl,
— здесь окислитель — хлор (он присоединяет к себе электроны), а восстановитель — натрий (он отдаёт электроны).
Реакция замещения NaBr-1+ Cl20→ 2NaCl-1 + Br20 (характерна для галогенов) тоже относится к окислительно -восстановительным реакциям. Здесь хлор — окислитель (принимает 1 электрон), а бромид натрия (NaBr) — восстановитель (атом брома отдаёт электрон).
Реакция разложения дихромата аммония ((NH4)2Cr2O7) тоже относится к окислительно-восстановительным реакциям:
(N-3H4)2Cr2+6O7→ N20 + Cr2+3O3 + 4H2O
Ещё одна из распространённых классификаций химических реакций — это их разделение по тепловому эффекту.
Разделяют эндотермические реакции и экзотермические реакции.
Эндотермические реакции — химические реакции, сопровождающиеся поглощением окружающего тепла (вспомните охлаждающие смеси). Экзотермические (наоборот) — химические реакции, сопровождающиеся выделением тепла (например — горение).
Опасные химические реакции :»БОМБА В РАКОВИНЕ»- забавно или не очень?!
Существуют некоторые химические реакции, которые протекают спонтанно при смешивании реагентов. При этом образуются достаточно опасные смеси, которые могут взрываться, воспламеняться или отравлять. Вот одна и них!
В некоторых американских и английских клиниках наблюдались странные явления. Время от времени из раковин раздавались звуки, напоминающие пистолетные выстрелы, а в одном случае неожиданно взорвалась сливная трубка. К счастью, никто не пострадал. Расследование показало, что виновником всего этого был очень слабый (0,01%) раствор азида натрия NaN3, который использовали в качестве консерванта физиологических растворов.
 Азид свинца
Азид свинца
Излишки раствора азида в течение многих месяцев, а то и лет сливали в раковины — иногда до 2 л в день.
Сам по себе азид натрия — соль азидоводородной кислоты HN3 — не взрывается. Однако азиды тяжёлых металлов (меди, серебра, ртути, свинца и др.) — весьма неустойчивые кристаллические соединения, которые взрываются при трении, ударе, нагревании, действии света. Взрыв может произойти даже под слоем воды! Азид свинца Pb(N3)2 используется как инициирующее взрывчатое вещество, с помощью которого подрывают основную массу взрывчатки. Для этого достаточно всего двух десятков миллиграммов Pb(N3)2. Это соединение более взрывчато, чем нитроглицерин, а скорость детонации (распространения взрывной волны) при взрыве достигает 45 км/с — в 10 раз больше, чем у тротила.
Но откуда в клиниках могли взяться азиды тяжёлых металлов? Оказалось, во всех случаях сливные трубки под раковинами были изготовлены из меди или латуни (такие трубки легко гнутся, особенно после нагревания, поэтому их удобно устанавливать в сливной системе). Выливаемый в раковины раствор азида натрия, протекая по таким трубкам, постепенно реагировал с их поверхностью, образуя азид меди. Пришлось менять трубки на пластмассовые. Когда в одной из клиник проводили такую замену, оказалось, что снятые медные трубки сильно забиты твёрдым веществом. Специалисты, которые занимались «разминированием», чтобы не рисковать, подорвали эти трубки на месте, сложив их в металлический бак массой 1 т. Взрыв был настолько силён, что сдвинул бак на несколько сантиметров!
Медиков не очень интересовала сущность химических реакций, приводящих к образованию взрывчатки. В химической литературе также не удалось найти описания этого процесса. Но можно предположить, исходя из сильных окислительных свойств HN3, что имела место такая реакция: анион N-3, окисляя медь, образовал одну молекулу N2 и атом азота, который вошёл в состав аммиака. Это соответствует уравнению реакции: 3NaN3+Cu+3Н2О→ Cu(N3)2+3NaOH+N2+NH3.
С опасностью образования бомбы в раковине приходится считаться всем, кто имеет дело с растворимыми азидами металлов, в том числе и химикам, поскольку азиды используются для получения особо чистого азота, в органическом синтезе, в качестве порообразователя (вспенивающего агента для производства газонаполненных материалов: пенопластов, пористой резины и т. п.). Во всех подобных случаях надо проследить, чтобы сливные трубки были пластмассовыми.
Сравнительно недавно азиды нашли новое применение в автомобилестроении. В 1989 г. в некоторых моделях американских автомобилей появились надувные подушки безопасности. Такая подушка, содержащая азид натрия, в сложенном виде почти незаметна. При лобовом столкновении электрический запал приводит к очень быстрому разложению азида: 2NaN3=2Na+3N2. 100 г порошка выделяют около 60 л азота, который примерно за 0,04 с надувает подушку перед грудью водителя, спасая тем самым ему жизнь.
Поняти простой и сложной реакции.(пример). Молекулярность реакции. (пример). Механизм реакции.(пример). Понятие лимитирующее стадии.
Совокупность стадий, через которые протекает химическая реакция называется механизмом реакции.Синтез HI включает две стадии:
1.Образование АК. При этом затрачивается энергия. ∆Е = 198 кДж/моль.
2. Распад АК на две молекулы HI . При этом выделяется энергия. ∆Е = -171 кДж/моль.
Первая стадия менее выгодна по энергии, значит менее вероятна и идет с меньшей скоростью. Скорость сложного процесса будет определяться самой медленной стадией, которая называется лимитирующей. Поэтому подбирают такие способы получения вещества, чтобы их скорость была максимальна. Одним из таких способов является использование катализаторов.
Все реакции можно подразделить на простые и сложные. Простые реакции протекают в одну стадию и называются одностадийными. Сложные реакции идут либо последовательно (многостадийные реакции), либо параллельно, либо последовательно—параллельно. В свою очередь, в каждой стадии реакции может участвовать одна молекула (мономолекулярные реакции), две молекулы (бимолекулярные реакции) и три молекулы (тримолекулярные реакции).
Число молекул реагента, принимающих участие в простейшей (элементарной) стадии, называется ее молекулярностью.
Одностадийные реакции. Относительно небольшое число реакций протекает в одну стадию. К одностадийным реакциям, например,
относятся:
реакции диссоциации
Н2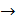 2Н, С12
2Н, С12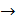 2С1, 2HI
2С1, 2HI 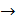 Н2 +l2.
Н2 +l2.
взаимодействие иода и водорода
I + Н2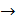 2HI
2HI
взаимодействие моноксида азота с водородом и озоном
2NO + Н2 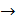 N20 + Н20
N20 + Н20
NO + O3 = N0 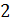 + 0
+ 0 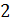
Сложные реакции. К сложным относятся реакции, протекающие последовательно через несколько стадий, или параллельно. Большинство реакций являются многостадийными.
Если одна из этих стадий протекает значительно медленнее других, то эта стадия будет определять скорость всего процесса, и ее называют лимитирующей стадией.
Обычно лимитирующая стадия записывается как необратимая реакция, а другие стадии как обратимые реакции. Например:
N2O2 ↔NO2 + NO3 (быстрая реакция)
NO2 + NO3 → NO2 + NO + O2 (медленная реакция)
NO + NO3 ↔ 2NO2 (быстрая стадия)
Лимитирующая вторая стадия.
8) Катализом называется явление изменения скорости реакции под действием некоторых веществ (катализаторами) и не входящими в стехиометрическое уравнение реакции, которые участвуют в процессе, но к концу реакции остаются неизменными. Катализ называется положительным, если скорость реакции увеличивается и отрицательным, если уменьшается, при добавлении катализатора. В присутствии катализатора образуется другой АК (активированный комплекс) с меньшей ЕА ( энергия активации реакции) и реакция ускоряется.
Св-ва катализатора:
-Катализатор ускоряет только термодинамически возможные реакции
-Катализатор в ходе реакции сохраняет количество и химический состав, но не физическое состояние
-В равной степени ускоряет прямую и обратную реакции, следовательно не смещает равновесие
-Разные катализаторы с одним и теми же исходными веществами образуют разные АК, значит могут образовывать разные продукты реакции, это свойство называется- селективностью катализатора.
9). При гомогенном катализе молекулы реагирующих веществ и катализатора находятся в одной фазе (жидкой или газооб.), в которой образуют АК.
10). При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Простые и удобные задания на время реакции
В когнитивной экспериментальной психологии мы различаем простые
и выбор времени отклика задач. Эти два термина используются во многих
книжные статьи по когнитивной психологии. Этот урок объясняет и
демонстрирует, что мы имеем в виду под простыми задачами с произвольным временем отклика.
| Тип | Определение | Примеры |
|---|---|---|
Задача простого времени отклика (SRT) | Есть только один стимул, и когда он появляется, вам нужно ответить той же реакцией, которая есть в эксперименте этого типа | Каждый раз, когда вы видите, что загорается лампочка, вам нужно нажимать клавишу пробела на клавиатуре вашего компьютера.Или спортсмен начинает бежать, когда выстрелил стартовый пистолет. |
Задача выбора времени отклика (CRT) | Есть несколько стимулов, и каждый из них требует разной реакции | Вы увидите одно из 10 представленных писем. Каждый раз, когда вы видите букву, вам нужно нажимать соответствующую буквенную клавишу на клавиатуре. |
Люди (и животные) могут реагировать намного быстрее, когда есть только один
стимул и один тип ответа (задача Simple Response Time).Так же
чем больше стимулов и ответов, тем медленнее вы работаете (это
известный как закон Хика).
| Вообще говоря, когда есть только один стимул и один ответа, многие люди могут ответить значительно ниже 200 мс, то есть меньше 1/5 секунды! На выбор время реакции с 2 стимулами и 2 ответы (это простейшая задача выбора времени отклика), ответ в течение 250 мс, вероятно, самый быстрый из возможных, но обычно люди имеют средний ответ от 350 до 450 мс.Опять же, на это может повлиять множество факторов, в том числе точный тип стимула и режим реакции. |
В настоящее время точно установлено, что скорость реакции человека
под влиянием возраста и общего интеллекта (например, Дири, Левальд и
Nissan, 2011 г.). Важно отметить, что многие другие факторы играют важную роль.
роль, например, условия, в которых вы выполняете
задача (вы в форме или устали, голодны и т. д.). Кроме того, ваша скорость
зависит от того, насколько точным вы стремитесь.Если вы не хотите
ошибки, вы станете медленнее. Это известно как точность скорости.
компромисс (это восходит к работе Вудворта, 1899 г .;
обзор см. Heitz, 2014).
Важно понимать, что время отклика играет решающую роль.
в экспериментальной когнитивной психологии. Основная идея заключается в том, что ответ
время отражает время, необходимое для интерпретации стимула, получить
информация из памяти, инициирование мышечной реакции и т. д. Таким образом,
время отклика можно использовать, чтобы узнать, как долго основная мысль
процессы берут.Эта идея восходит к работам ранних
экспериментируют психологи во второй половине 19 века (когда
термина «когнитивная психология» даже не существовало). Один из
ведущей фигурой в этой области исследований был голландский офтальмолог.
Франциск Дондерс.
.
Химическая реакция — Простая английская Википедия, бесплатная энциклопедия
 Костер — пример окислительно-восстановительного потенциала
Костер — пример окислительно-восстановительного потенциала
Химическая реакция происходит, когда один или несколько химикатов превращаются в один или несколько других. Примеры:
Некоторые реакции бывают быстрыми, другие — медленными. Некоторые происходят с разной скоростью, в зависимости от температуры или других факторов. Например, древесина не реагирует с воздухом, когда она холодная, но если ее нагреть достаточно, она начнет гореть.Некоторые реакции выделяют энергию. Это экзотермические реакции. В других реакциях потребляется энергия. Это эндотермические реакции.
Ядерные реакции — это , а не химические реакции. В химических реакциях участвуют только электроны атомов; В ядерных реакциях участвуют протоны и нейтроны в атомных ядрах.
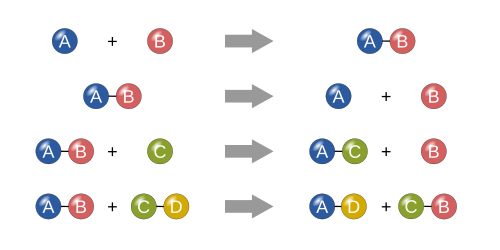 Четыре основных типа химических реакций: синтез, разложение, однократное замещение и двойное замещение.
Четыре основных типа химических реакций: синтез, разложение, однократное замещение и двойное замещение.
Синтез [изменение | изменить источник]
В реакции синтеза два или более простых вещества объединяются в более сложное вещество.
- A + B⟶AB {\ displaystyle A + B \ longrightarrow AB}
«Два или более реагентов, дающих один продукт» — еще один способ идентифицировать реакцию синтеза. Одним из примеров реакции синтеза является сочетание железа и серы с образованием сульфида железа (II):
- 8Fe + S8⟶8FeS {\ displaystyle 8Fe + S_ {8} \ longrightarrow 8FeS}
Другой пример — простой газообразный водород в сочетании с простым газообразным кислородом для образования более сложного вещества, такого как вода. [1]
Разложение [изменение | изменить источник]
Реакция разложения — это когда более сложное вещество распадается на более простые части. Таким образом, это противоположно реакции синтеза и может быть записано как: [1] [2]
- AB⟶A + B {\ displaystyle AB \ longrightarrow A + B}
Одним из примеров реакции разложения является электролиз воды с образованием кислорода и водорода:
- 2h3O⟶2h3 + O2 {\ displaystyle 2H_ {2} O \ longrightarrow 2H_ {2} + O_ {2}}
Одна замена [изменение | изменить источник]
В единственной реакции замещения один несоединенный элемент заменяет другой в соединении; другими словами, один элемент заменяется другим элементом в соединении [1] Эти реакции протекают в общей форме:
- A + BC⟶AC + B {\ displaystyle A + BC \ longrightarrow AC + B}
Одним из примеров реакции однократного замещения является то, когда магний заменяет водород в воде с образованием гидроксида магния и газообразного водорода:
- Mg + 2h3O⟶Mg (OH) 2 + h3 {\ displaystyle Mg + 2H_ {2} O \ longrightarrow Mg (OH) _ {2} + H_ {2}}
Двойная замена [изменение | изменить источник]
В реакции двойного замещения анионы и катионы двух соединений меняются местами и образуют два совершенно разных соединения. [1] Эти реакции имеют общий вид: [2]
- AB + CD⟶AD + CB {\ displaystyle AB + CD \ longrightarrow AD + CB}
Например, когда взаимодействуют хлорид бария (BaCl 2 ) и сульфат магния (MgSO 4 ), SO 4 2− анион переключает местами с анионом 2Cl —, давая соединения BaSO 4 и MgCl 2 .
Другим примером реакции двойного замещения является реакция нитрата свинца (II) с иодидом калия с образованием иодида свинца (II) и нитрата калия:
- Pb (NO3) 2 + 2KI⟶PbI2 + 2KNO3 {\ displaystyle Pb (NO_ {3}) _ {2} + 2KI \ longrightarrow PbI_ {2} + 2KNO_ {3}}
Химическая реакция отображается уравнением:
- A + B⟶C + D {\ displaystyle \ mathrm {A + B \ longrightarrow C + D}}
- Здесь A и B реагируют с C и D в химической реакции.
- Это пример реакции горения .
C + O2⟶CO2 {\ displaystyle \ mathrm {C + O_ {2} \ longrightarrow CO_ {2}}}
- углерод + кислород → диоксид углерода
.
19 Классные химические реакции, доказывающие, что наука увлекательна
Химия может быть одной из самых завораживающих, но также и опасных наук. Смешивание определенных химикатов может вызвать довольно неожиданные реакции, которые могут быть интересны для демонстрации. Хотя некоторые реакции можно наблюдать ежедневно, например, смешивание сахара с кофе, некоторые требуют контролируемых условий для визуализации эффектов. Но есть некоторые химические реакции, наблюдать за которыми просто потрясающе, и их легко провести в химических лабораториях.
В целях вашей безопасности самый простой выход — посмотреть видео с такими впечатляющими химическими реакциями, прежде чем вы подумаете об их воспроизведении, чтобы лучше понять уровень риска и необходимые меры предосторожности.
Вот список из 19 самых потрясающих химических реакций, которые доказывают, что наука всегда крута.
1. Полиакрилат натрия и вода
Полиакрилат натрия — это суперабсорбентный полимер. Подводя итог реакции, ионы полимера притягивают воду путем диффузии.Полимер поглощает воду за секунды, что приводит к почти мгновенному превращению в гелеобразное вещество. Именно это химическое вещество используется в подгузниках для поглощения отработанной жидкости. Технически это не химическая реакция, потому что химическая структура не меняется и не происходит реакции с молекулами воды. Скорее, это демонстрация поглощения в макроуровне.
2. Диэтилцинк и воздух
Диэтилцинк — очень нестабильное соединение.При контакте с воздухом он горит с образованием оксида цинка, CO2 и воды. Реакция происходит, когда диэтилцинк вступает в контакт с молекулами кислорода. Химическое уравнение выглядит следующим образом:
Zn (C2H5) 2 + 5O2 → ZnO + 4CO2 + 5h3O
3. Цезий и вода
 Источник: Giphy
Источник: Giphy
Цезий — один из наиболее реактивных щелочных металлов. При контакте с водой он реагирует с образованием гидроксида цезия и газообразного водорода. Эта реакция происходит так быстро, что вокруг цезия образуется пузырек водорода, который поднимается на поверхность, после чего цезий подвергается воздействию воды, вызывая дальнейшую экзотермическую реакцию, таким образом воспламеняя газообразный водород.Этот цикл повторяется до тех пор, пока не будет исчерпан весь цезий.
4. Глюконат кальция
Глюконат кальция обычно используется для лечения дефицита кальция. Однако, когда он нагревается, он вызывает огромное расширение молекулярной структуры. Это приводит к образованию пены, напоминающей серую змею, вызванной испарением воды и дегидратацией гидроксильных групп внутри соединения. Говоря менее научным языком, при нагревании глюконат кальция быстро разлагается. Реакция выглядит следующим образом:
2C 12 H 22 CaO 14 + O 2 → 22H 2 O + 21C + 2CaO + 3CO 2
5.Трииодид азота
Это соединение можно приготовить дома, но имейте в виду, что это очень опасно. Соединение образуется в результате осторожной реакции йода и аммиака. После высыхания исходных компонентов образуется NI3, который является очень реактивным соединением. Простое прикосновение пера вызовет взрыв этого очень опасного контактного взрывчатого вещества.
6. Дихромат аммония
Когда дихромат аммония воспламеняется, он разлагается экзотермически с образованием искр, золы, пара и азота.
7. Перекись водорода и иодид калия
Когда перекись водорода и иодид калия смешиваются в надлежащих пропорциях, перекись водорода разлагается очень быстро. В эту реакцию часто добавляют мыло, чтобы в результате образовалось пенистое вещество. Мыльная вода улавливает кислород, продукт реакции, и создает множество пузырьков.
8. Хлорат калия и конфеты
Мармеладные мишки — это, по сути, просто сахароза.Когда мармеладные мишки попадают в хлорат калия, он вступает в реакцию с молекулой глюкозы в сахарозе, что приводит к сильно экзотермической реакции горения.
9. Реакция Белоусова-Жаботинского (BZ)
Реакция BZ образуется при осторожном сочетании брома и кислоты. Реакция является ярким примером неравновесной термодинамики, которая приводит к красочным химическим колебаниям, которые вы видите на видео выше.
10.Окись азота и сероуглерод
Реакция, часто называемая «лающей собакой», представляет собой химическую реакцию в результате воспламенения сероуглерода и закиси азота. Реакция дает яркую синюю вспышку и очевидный звук глухой. Реагенты реакции быстро разлагаются в процессе горения.
11. Сплав NaK и вода
Сплав NaK представляет собой металлический сплав, образованный смешением натрия и калия вне воздуха, обычно в керосине.Этот чрезвычайно реактивный материал может реагировать с воздухом, но еще более бурная реакция происходит при контакте с водой.
12. Термит и лед
Вы когда-нибудь думали, что смешивание огня и льда может привести к взрыву?
СВЯЗАННЫЕ: 11 ЛУЧШИХ ХИМИЧЕСКИХ КАНАЛОВ НА YOUTUBE
Вот что происходит, когда вы получаете небольшую помощь от Thermite, который представляет собой смесь алюминиевого порошка и оксида металла. Когда эта смесь воспламеняется, происходит экзотермическая окислительно-восстановительная реакция, т.е.е. химическая реакция, при которой энергия выделяется в виде электронов, которые переходят между двумя веществами. Таким образом, когда термит помещается на поверхность льда и воспламеняется с помощью пламени, лед сразу же загорается, и выделяется большое количество тепла в виде взрыва. Однако нет какой-либо убедительной научной теории о том, почему термит вызывает взрыв. Но одно ясно из демонстрационного видео — не пробуйте это дома.
13.Осциллирующие часы Бриггса-Раушера
Реакция Бриггса-Раушера — одна из очень немногих колеблющихся химических реакций. Реакция дает визуально ошеломляющий эффект за счет изменения цвета раствора. Для инициирования реакции смешивают три бесцветных раствора. Полученный раствор будет циклически менять цвет с прозрачного на янтарный в течение 3-5 минут и в итоге станет темно-синим. Три раствора, необходимые для этого наблюдения, представляют собой разбавленную смесь серной кислоты (H 2 SO 4 ) и йодата калия (KIO 3 ), разбавленную смесь малоновой кислоты (HOOOCCH 2 COOH), моногидрат сульфата марганца. (МнСО 4 .H 2 O) и крахмал витекс и, наконец, разбавленный пероксид водорода (H 2 O 2 ).
14. Supercool Water
Возможно, вы не заморозите окружающую среду, как Эльза в фильме «Холодное сердце», но вы определенно можете заморозить воду прикосновением к этому классному научному эксперименту. Эксперимент с супер холодной водой заключается в охлаждении очищенной воды до -24 ° C (-11 ° F). Охлажденную бутылку можно медленно вынуть и постучать по дну или по бокам, чтобы запустить процесс кристаллизации.Поскольку очищенная вода не имеет примесей, молекулы воды не имеют ядра для образования твердых кристаллов. Внешняя энергия, обеспечиваемая в виде крана или удара, заставит молекулы переохлажденной воды образовывать твердые кристаллы посредством зародышеобразования и запустит цепную реакцию по кристаллизации воды по всей бутылке.
15. Феррожидкость
Ферромагнитная жидкость состоит из наноразмерных ферромагнитных частиц, взвешенных в несущей жидкости, такой как органический растворитель или вода.Изначально обнаруженные Исследовательским центром НАСА в 1960-х годах в рамках исследования по поиску методов контроля жидкостей в космосе, феррожидкости при воздействии сильных магнитных полей будут создавать впечатляющие формы и узоры. Эти жидкости могут быть приготовлены путем объединения определенных пропорций соли Fe (II) и соли Fe (III) в основном растворе с образованием валентного оксида (Fe 3 O 4 ).
16. Гигантский пузырь сухого льда
Сухой лед всегда является забавным веществом для разнообразных экспериментов.Если вам удастся найти немного сухого льда, попробуйте в этом эксперименте создать гигантский пузырь из простых материалов. Возьмите миску и наполовину наполните ее водой. Смочите жидкое мыло водой и перемешайте. Пальцами намочите края миски и добавьте в раствор сухой лед. Окуните полоску ткани в мыльную воду и протяните ее по всему краю миски. Подождите, пока пары сухого льда не задержатся внутри пузыря, который начнет постепенно расширяться.
17. Змея фараона
Змея фараона — это простая демонстрация фейерверка.Когда тиоцианат ртути воспламеняется, он распадается на три продукта, и каждый из них снова распадается на еще три вещества. Результатом этой реакции является растущий столб, напоминающий змею, с выделением пепла и дыма. Хотя все соединения ртути токсичны, лучший способ провести этот эксперимент — в вытяжном шкафу. Также существует серьезная опасность пожара. Однако самое простое решение — посмотреть видео, если у вас нет доступа к материалам.
18. Эффект Мейснера
Охлаждение сверхпроводника ниже температуры перехода сделает его диамагнитным.Это эффект, при котором объект будет отталкиваться от магнитного поля, а не тянуться к нему. Эффект Мейснера также привел к концепции транспортировки без трения, при которой объект может левитировать по рельсам, а не прикрепляться к колесам. Однако этот эффект также можно воспроизвести в лаборатории. Вам понадобится сверхпроводник и неодимовый магнит, а также жидкий азот. Охладите сверхпроводник жидким азотом и поместите сверху магнит, чтобы наблюдать левитацию.
19. Сверхтекучий гелий
Охлаждение гелия до достижения его лямбда-точки (-271 ° C) сделает его сверхтекучим, известным как гелий II. Эта сверхтекучая жидкость образует тонкую пленку внутри контейнера и будет подниматься против силы тяжести в поисках более теплого места. Тонкая пленка имеет толщину около 30 нм, в ней капиллярные силы превышают силу тяжести, которая удерживает жидкость в контейнере.
.
советов для игр и других видов спорта
Хотите выиграть миллионы, играя в видеоигры?
Наверное, это звучит для вас как подростковая мечта. Но 16-летний Кайл Гирсдорф из Пенсильвании воплотил эту мечту в реальность, заработав огромную зарплату в 3 миллиона долларов, выиграв чемпионат мира по Fortnite в 2019 году в Нью-Йорке.
Но как определить, насколько хорош геймер? Скорость.
Хотя некоторые исследования показывают, что время реакции увеличивается, вот несколько советов, которые помогут улучшить время реакции, чтобы вы могли победить конкурентов.
Итак, ключ к ускорению в любимой игре — это время реакции (RT). Это промежуток времени между стимулом и вашей реакцией на него.
RT контролируется вашей центральной нервной системой (ЦНС).
ЦНС включает около 100 миллиардов нервных клеток (или нейронов), которые получают сенсорную информацию посредством сигналов от ваших органов зрения, звука, запаха, осязания и вкуса. Они передают эти сигналы в ваш мозг, где они интерпретируются и превращаются в физические и умственные реакции.
И все это происходит за крошечные доли секунды — обычно от 150 до 300 миллисекунд.
Но имейте в виду, что есть разница между физическим и психическим RT:
- Психическое RT — это то, насколько быстро вы воспринимаете и обрабатываете стимул.
- Physical RT — это то, насколько быстро вы физически реагируете на раздражитель.
И есть еще одно последнее различие между реакциями и рефлексами, прежде чем мы перейдем к интересным вещам:
- Реакции: произвольных движения, которые можно тренировать, чтобы не только стать быстрее, но и реагировать на определенные стимулы
- Рефлексы: мгновенных непроизвольных движения, которые эволюционировали, чтобы защитить вас, например, удар ногой при нажатии ниже коленной чашечки.
Теперь вот что вы можете сделать, чтобы улучшить свой RT, чтобы лучше играть.
Практика. Практика. Практика!
Чтобы стать лучше в чем-либо, нужно просто много делать. Это особенно важно для вашего времени визуальной реакции (VRT), которое играет ключевую роль в играх.
Но повторение — это еще не все. Вам также необходимо столкнуться с разнообразными игровыми средами и пробовать разные решения одних и тех же повторяющихся проблем, чтобы вы могли импровизировать в непредвиденных ситуациях, когда приходит время столкнуться с реальными противниками.
Чем больше вы сможете сформировать привычки из этого опыта, тем больше у вас будет шансов быстро отреагировать, потому что вы превращаете обычные умственные вычисления в навязчивые действия, которые кажутся все более автоматическими.
Согрейте руки
Тепло помогает вашему телу быстрее реагировать.
Тепло означает, что атомы в молекулах движутся быстрее, и это приводит к более быстрым движениям клеток с момента получения сенсорного сигнала в нервную клетку до момента, когда ваше тело реагирует на этот стимул.
Так что играйте в теплой среде, надевайте специальные перчатки, которые позволят вам ловко обращаться с контроллером или клавиатурой, поместите обогреватель рядом с руками или просто держите поблизости чашку горячего кофе или чая, чтобы держать их, когда ваши руки остынут.
Играйте на высокопроизводительном оборудовании.
Это может потребовать некоторых вложений с вашей стороны, но оборудование, которое может быстро реагировать на вашу реакцию, может быть разницей между победой всего или поражением в первом раунде.
Есть две вещи, на которые следует обратить особое внимание при покупке монитора для игр:
- Гц. Сколько раз в секунду ваш монитор обновляет изображение на экране. Чем выше число, тем быстрее ваш мозг может обработать большое количество изображений и создать более быстрый цикл обратной связи между вашей реакцией и вашим сенсорным входом.Попробуйте выбрать монитор с частотой 120 Гц или выше.
- Задержка на входе. Это относится к тому, сколько времени проходит между вашими действиями на контроллере, мыши или клавиатуре и реакцией игры на эти действия. Меньшая задержка ввода означает, что игра быстрее отражает скорость ваших действий. Старайтесь использовать как можно меньше миллисекунд.
Вы можете увеличить время реакции и при занятиях другими видами спорта.
Бегите по неровной местности
Бегайте или тренируйтесь по неровной поверхности, чтобы вы научились быстро обрабатывать и реагировать на сигналы от непредсказуемых раздражителей, таких как камни, кусты и деревья.Это превращает игру на ровной поверхности в прогулку по парку — в буквальном смысле!
Тренируйте технику
Сначала пробуйте новые или сложные техники медленно, затем постепенно увеличивайте скорость по мере того, как вы станете лучше в них или почувствуете себя более комфортно при их выполнении. Это помогает вашему телу привыкнуть к ощущениям от этого движения или техники, чтобы выполнять его более естественно даже на более высоких скоростях.
Реагировать на сигнал
Найдите место, где вы можете потренироваться в том, как быстро вы реагируете на сигнал, такой как выстрел или удар хлыста.Это поможет вам лучше обучить мозг обрабатывать слуховые стимулы и превращать их во все более автоматические физические реакции.
Типичное время реакции человека составляет от 200 до 300 миллисекунд.
Вы можете использовать множество онлайн-инструментов для проверки времени реакции, например этот.
А вот еще один забавный способ, который вы можете попробовать с линейкой и другом:
- Попросите друга ущипнуть верхнюю часть линейки в самой высокой точке.
- Слегка разведите указательный и большой пальцы в нижней части линейки, как будто собираетесь ущипнуть ее.
- Пусть ваш друг отпустит линейку.
- Захватите линейку большим и указательным пальцами так быстро, как только сможете.
- Обратите внимание на то, где вы поймали линейку. Чем меньше расстояние может пройти линейка, тем быстрее будет ваша реакция.
Вот еще несколько факторов, которые могут повлиять на ваше время реакции:
Время реакции — ключ к игре, и вы можете многое сделать, чтобы улучшить его.
Независимо от того, являетесь ли вы обычным игроком, просто желающим стать лучше, или нацелены на чемпионаты, улучшение времени реакции может поднять ваше игровое мастерство на несколько ступеней и, по крайней мере, произвести впечатление на друзей.
.
