Тест с ответами: «Молекулярно-кинетическая теория»
1. Укажите пару веществ, скорость диффузии которых наибольшая при прочих равных условиях:
а) пары эфира и воздух +
б) раствор медного купороса и вода
в) вода и спирт
2. Броуновским движением называется:
а) конвекционное движение слоев жидкости при ее нагревании
б) хаотическое движение твердых частиц вещества, взвешенных в жидкости (или газе) +
в) упорядоченное движение твердых частиц вещества, взвешенных в жидкости (или газе)
3. Броуновское движение частиц пыльцы в воде объясняется:
а) наличием питательных веществ в воде
б) существованием сил притяжения и отталкивания между атомами в молекулах
в) непрерывностью и хаотичностью теплового движения молекул воды +
4. Какие частицы находятся в узлах решетки металла:
а) положительные ионы +
б) отрицательные частицы
в) нейтральные атомы
5. В процессе перехода вещества из жидкого состояния в кристаллическое:
а) существенно уменьшается расстояние между его молекулами
б) существенно увеличивается расстояние между его молекулами
в) существенно увеличивается упорядоченность в расположении его молекул +
6. В закрытом сосуде с сухими стенками воздух немного нагрели. Как при этом изменились концентрация молекул воды и относительная влажности воздуха в сосуде:
а) концентрация уменьшилась, а относительная влажность увеличилась
б) концентрация не изменилась, а относительная влажность уменьшилась +
в) концентрация увеличилась, а относительная влажность не изменилась
7. В закрытом сосуде с сухими стенками температура воздуха немного понизилась. Как при этом изменилась концентрация молекул воды и относительная влажность воздуха в сосуде, если роса не появилась:
а) концентрация уменьшилась, а относительная влажность увеличилась
б) и концентрация, и относительная влажность уменьшились
в) концентрация не изменилась, а относительная влажность увеличилась +
8. Плотность воды при температуре 100 °С равна 950 кг/м3, а наибольшая плотность водяного пара при 100 °С равна 0,59 кг/м3. Такое различие плотностей связано с тем, что:
а) число молекул в 1 м3 пара меньше чем в 1 м3 воды +
б) при переходе молекул из жидкости в пар уменьшается энергия их взаимодействия
в) молекулы жидкости и пара имеют разные массы
9. Если толчёный мел размешать в воде, то частицы мела будут долго «висеть» в толще воды, не оседая на дно. Это явление объясняется тем, что:
а) Земля не притягивает столь мелкие частицы
б) температура частиц мела выше температуры воды
в) частицы мела совершают броуновское движение в воде +
10. Средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна:
а) среднеквадратичной скорости его молекул
б) среднему квадрату скорости его молекул +
в) квадрату средней скорости его молекул
11. Частицы вещества находятся, в среднем, на таких больших расстояниях друг от друга, при которых силы взаимодействия между ними незначительны. В этом агрегатном состоянии вещество:
а) хорошо сжимается +
б) сохраняет начальный объём
в) сохраняет свою начальную форму
12. Хаотичность теплового движения молекул газа в небольшом сосуде приводит к тому, что:
а) газ легко сжимается
б) плотность газа одинакова во всех точках занимаемого им сосуда +
в) при охлаждении и сжатии газ превращается в жидкость
13. Молекулы вещества:
а) могут и притягиваться, и отталкиваться друг от друга +
б) только отталкиваются друг от друга
в) только притягиваются друг к другу
14. При неизменной плотности одноатомного идеального газа давление этого газа увеличивают в 4 раза. При этом среднеквадратичная скорость движения его атомов:
а) уменьшается в 4 раза
б) увеличивается в 4 раза
в) увеличивается в 2 раза +
15. Как изменится давление разреженного газа, если при его нагревании и сжатии абсолютная температура газа и концентрация молекул увеличатся в 2 раза:
а) увеличится в 4 раза +
б) увеличится в 8 раз
в) не изменится
16. Как изменится давление разреженного газа, если среднюю кинетическую энергию теплового движения молекул газа уменьшить в 2 раза и концентрацию молекул газа уменьшить в 2 раза:
а) уменьшится в 2 раза
б) уменьшится в 4 раза +
в) увеличится в 4 раза
17. Если давление идеального газа при постоянной концентрации увеличилось в 2 раза, то это значит, что его абсолютная температура:
а) уменьшилась в 4 раза
б) увеличилась в 4 раза
в) увеличилась в 2 раза +
18. Плотность ≈ 0,18 кг/м3 при нормальном атмосферном давлении и температуре 0 °С имеет:
а) кислород
б) гелий +
в) водород
19. При увеличении средней кинетической энергии теплового движения молекул в 2 раза абсолютная температура:
а) уменьшится в 4 раза
б) увеличится в 4 раза
в) увеличится в 2 раза +
20. При увеличении средней квадратичной скорости теплового движения молекул в 2 раза средняя кинетическая энергия теплового движения молекул:
а) уменьшится в 4 раза
б) увеличится в 4 раза +
в) увеличится в 2 раза
21. При понижении абсолютной температуры идеального газа в 1,5 раза средняя кинетическая энергия теплового движения молекул:
а) уменьшится в 1,5 раза +
б) уменьшится в 2,25 раза
в) увеличится в 1,5 раза
22. При увеличении средней кинетической энергии теплового движения молекул в 4 раза их средняя квадратичная скорость:
а) увеличится в 4 раза
б) увеличится в 2 раза +
в) уменьшится в 4 раза
23. При уменьшении средней кинетической энергии теплового движения молекул в 2 раза абсолютная температура:
а) увеличится в 4 раза
б) увеличится в 2 раза
в) уменьшится в 2 раза +
24. При понижении абсолютной температуры идеального газа в 2 раза средняя кинетическая энергия теплового движения молекул:
а) уменьшится в 4 раза
б) уменьшится в 2 раза +
в) увеличится в 2 раза
25. При уменьшении средней квадратичной скорости теплового движения молекул в 2 раза средняя кинетическая энергия теплового движения молекул:
а) увеличится в 4 раза
б) не изменится
в) уменьшится в 4 раза +
26. При повышении абсолютной температуры идеального газа в 2 раза средняя кинетическая энергия теплового движения молекул:
а) уменьшится в 2 раза
б) увеличится в 2 раза +
в) не изменится
27. Тепловым движением частиц вещества можно объяснить:
а) давление газа на стенку сосуда +
б) гидростатическое давление жидкости на дно сосуда
в) оба варианта верны
28. Как изменится давление разреженного одноатомного газа, если абсолютная температура газа уменьшится в 3 раза, а концентрация молекул увеличится в 3 раза:
а) уменьшится в 4 раза
б) увеличится в 2 раза
в) не изменится +
29. Средняя кинетическая энергия поступательного теплового движения молекул разреженного газа увеличилась в 2 раза, а концентрация его молекул уменьшилась в 2 раза. При этом давление газа:
а) не изменилось +
б) уменьшилось в 4 раза
в) увеличилось в 2 раза
30. Абсолютная температура идеального газа в сосуде увеличилась в 1,5 раза, а давление возросло при этом в 4,5 раза. Как изменилась концентрация молекул газа:
а) уменьшилась в 3 раза
б) увеличилась в 3 раза +
в) не изменилась
Тест по физике 10 класс «Основы МКТ»
Тест №3 «Основы МКТ»
Вариант 1
Как обозначается число молекул?
А. ρ. Б. m. В. m0. Г. ν. Д. N.
Как обозначается масса вещества?
А. ρ. Б. m. В. m0. Г. ν. Д. N.
Как обозначается средняя квадратичная скорость?
А. NA. Б. p. В. n. Г. Нет правильного ответа
Как обозначается концентрация?
А. NA. Б. p. В. n. Г.  . Д.
. Д.  .
.
Как обозначается температура по шкале Цельсия?
А.  . Б. t. В. T. Г. k. Д. V.
. Б. t. В. T. Г. k. Д. V.
Как обозначается относительная молекулярная масса?
А. R. Б. Мr. В. М T. Г. k. Д. V.
Как обозначается объем?
А.  . Б. t. В. T. Г. k. Д. V.
. Б. t. В. T. Г. k. Д. V.
В каких единицах измеряется число молекул?
А. кг/м3. Б. кг. В. моль. Г. 1/моль. Д. нет правильного.
В каких единицах измеряется плотность?
А. кг/м3. Б. кг. В. моль. Г. 1/моль. Д. нет правильного.
В каких единицах измеряется масса?
А. кг/м3. Б. кг. В. моль. Г. 1/моль. Д. нет правильного.
Как записывается формула для определения плотности?
А. 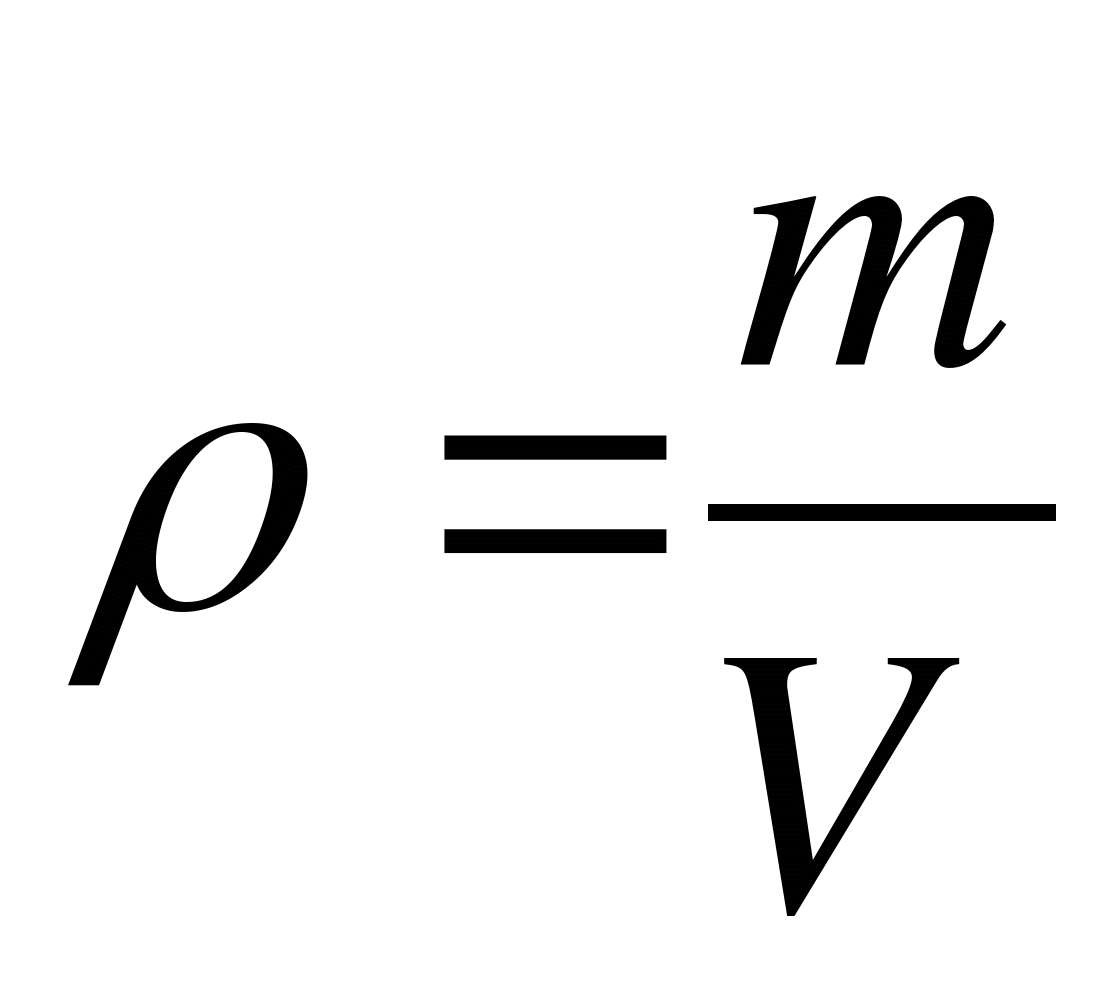 . Б.
. Б. 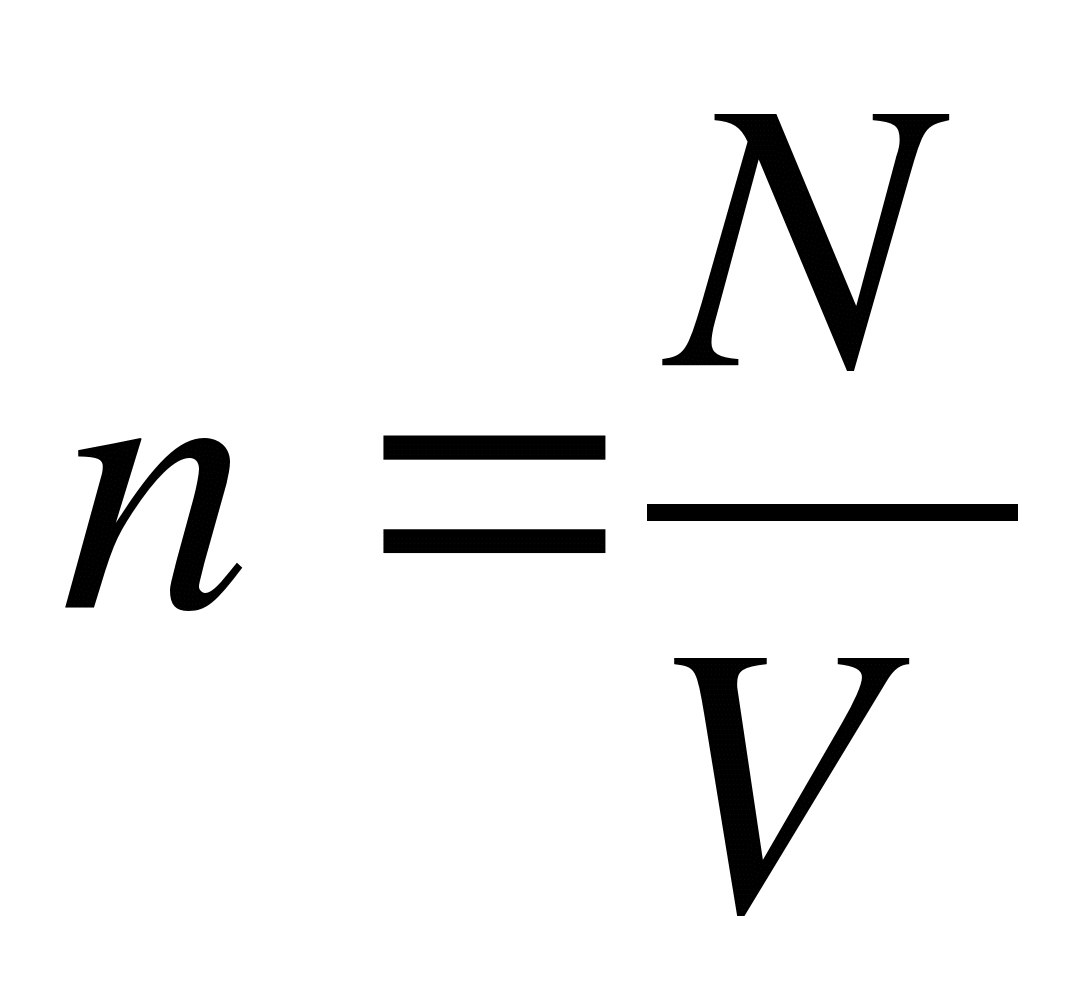 . В.
. В. 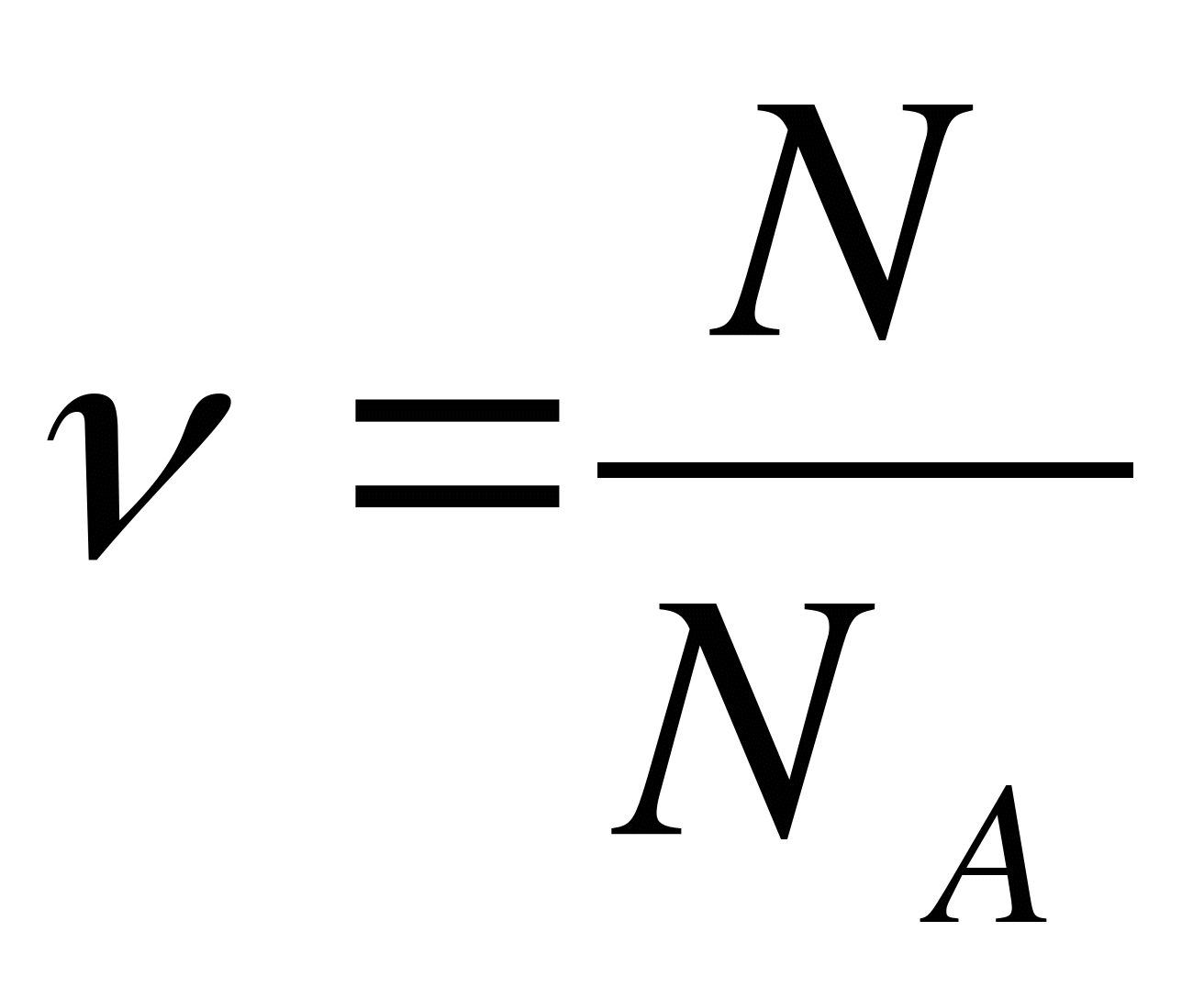 . Г.
. Г. 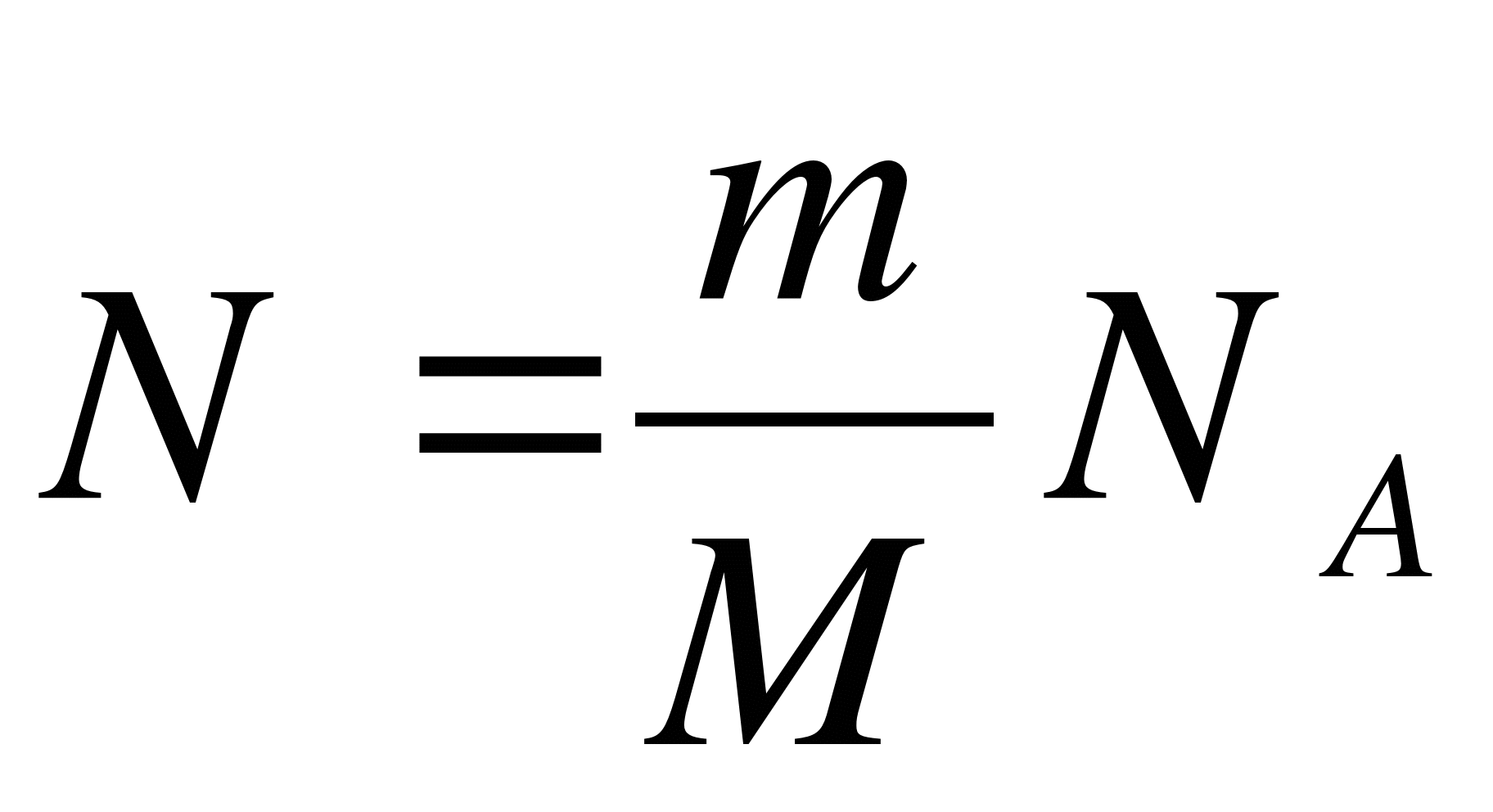 . Д.
. Д. 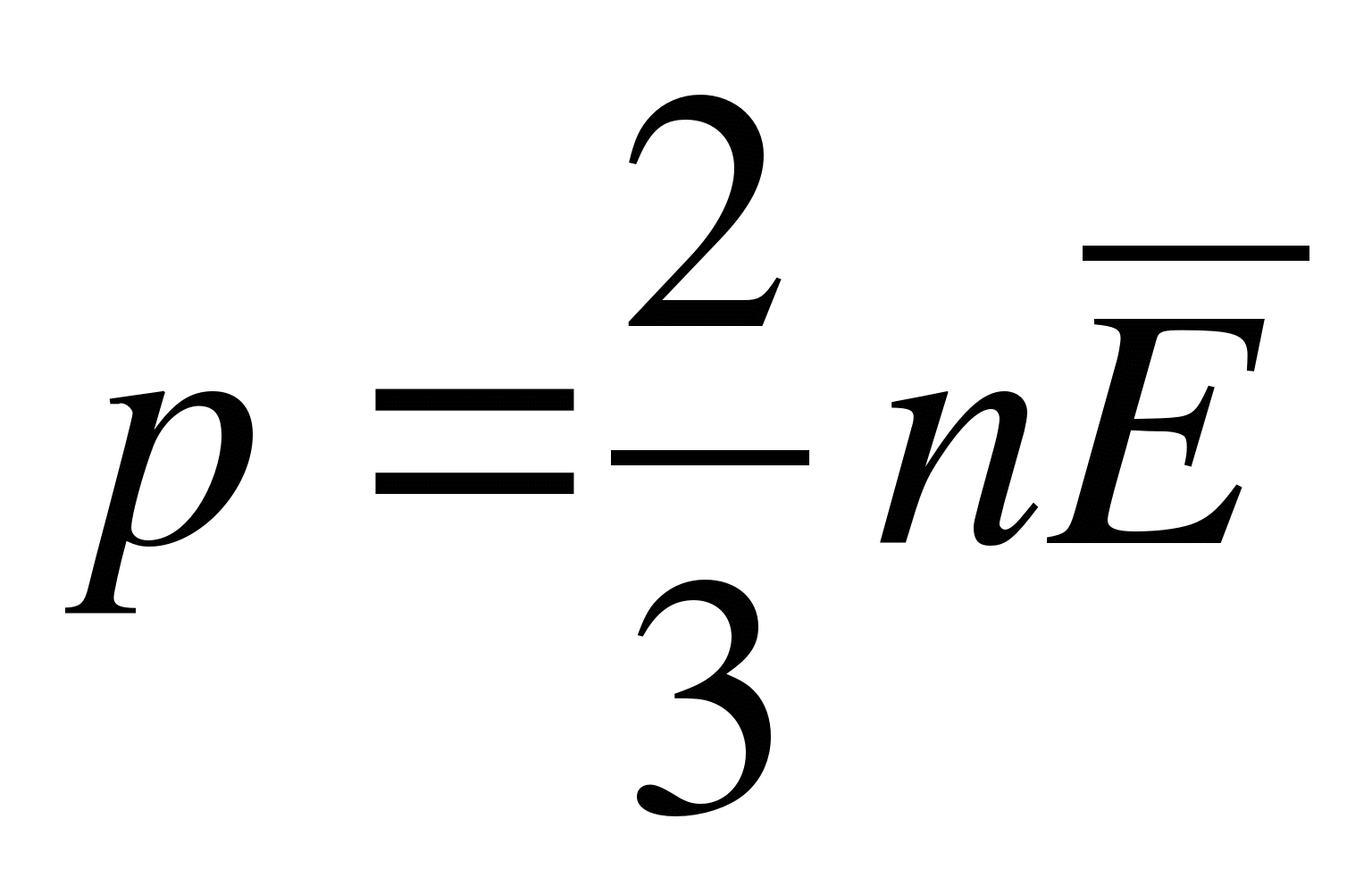 .
.
Как записывается формула для определения количества вещества?
А. 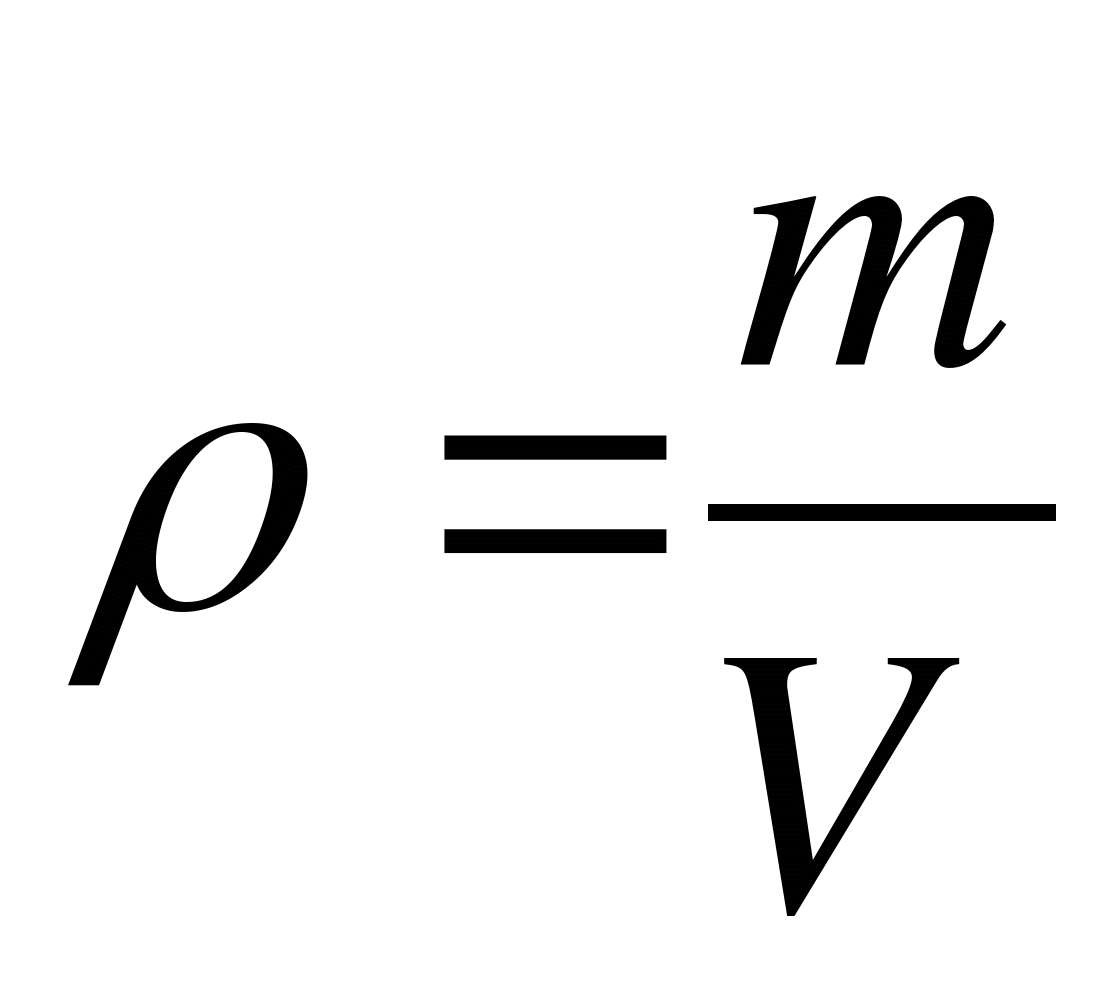 . Б.
. Б. 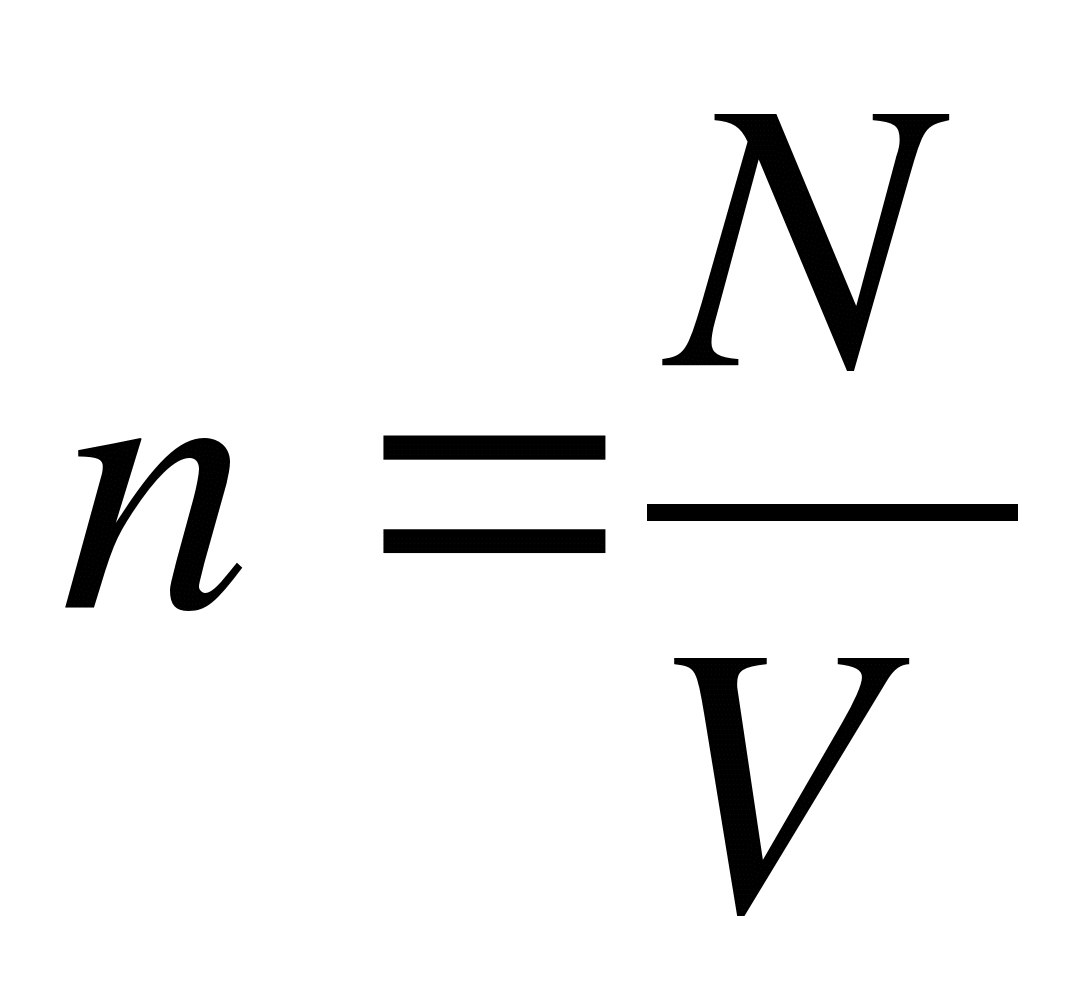 . В.
. В. 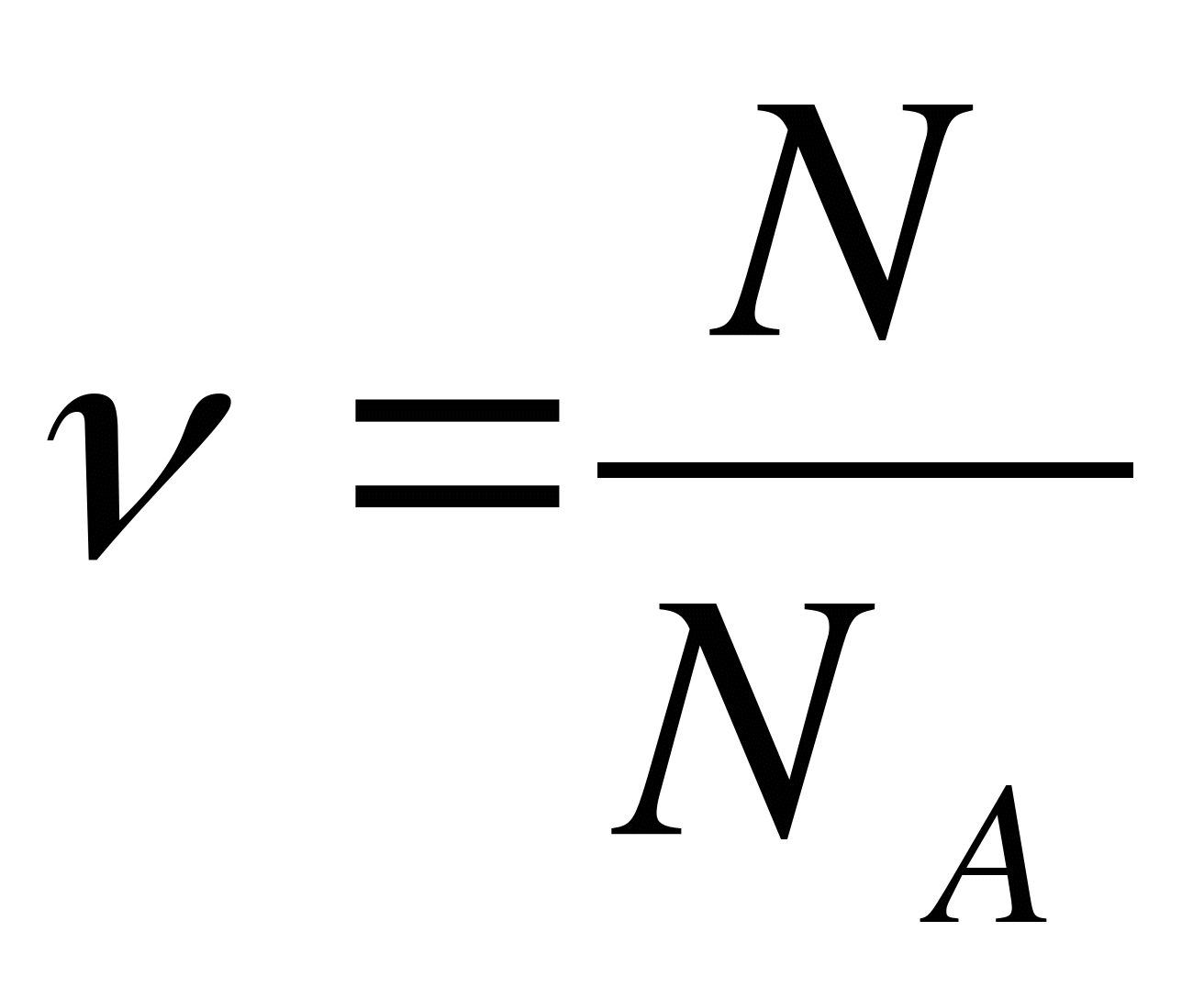 . Г.
. Г. 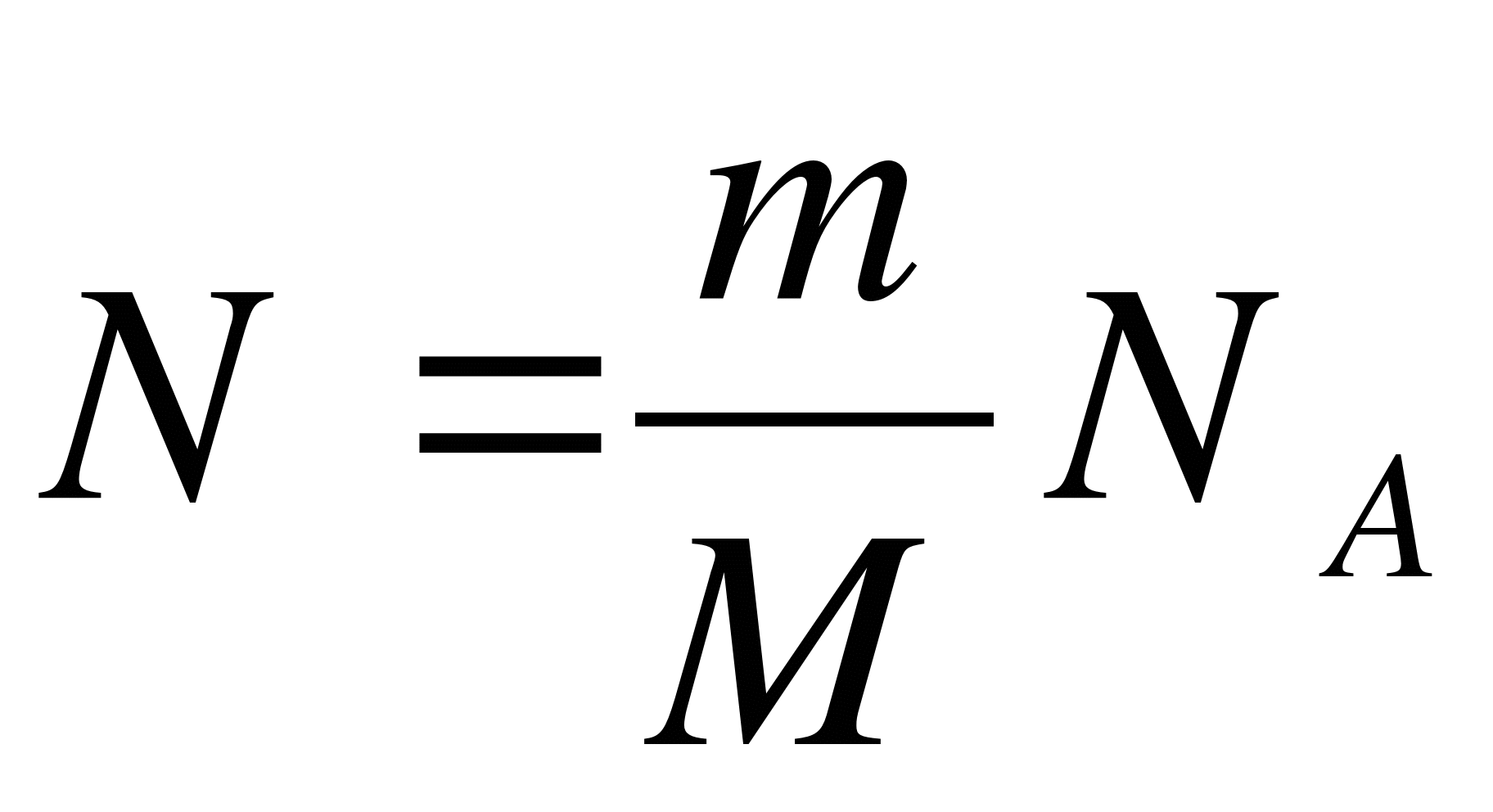 . Д.
. Д. 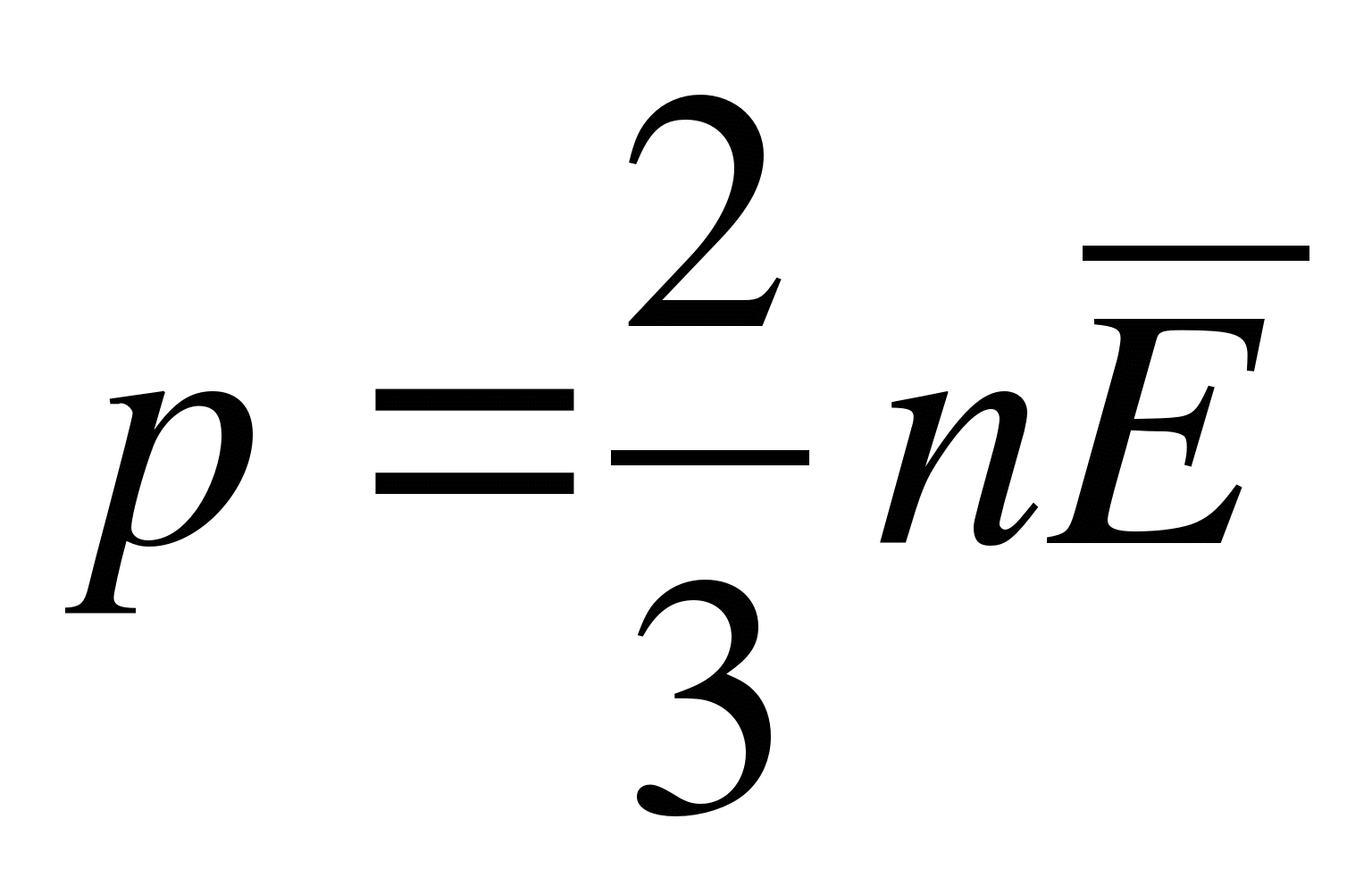 .
.
Как записывается основное уравнение молекулярно-кинетической теории?
А. 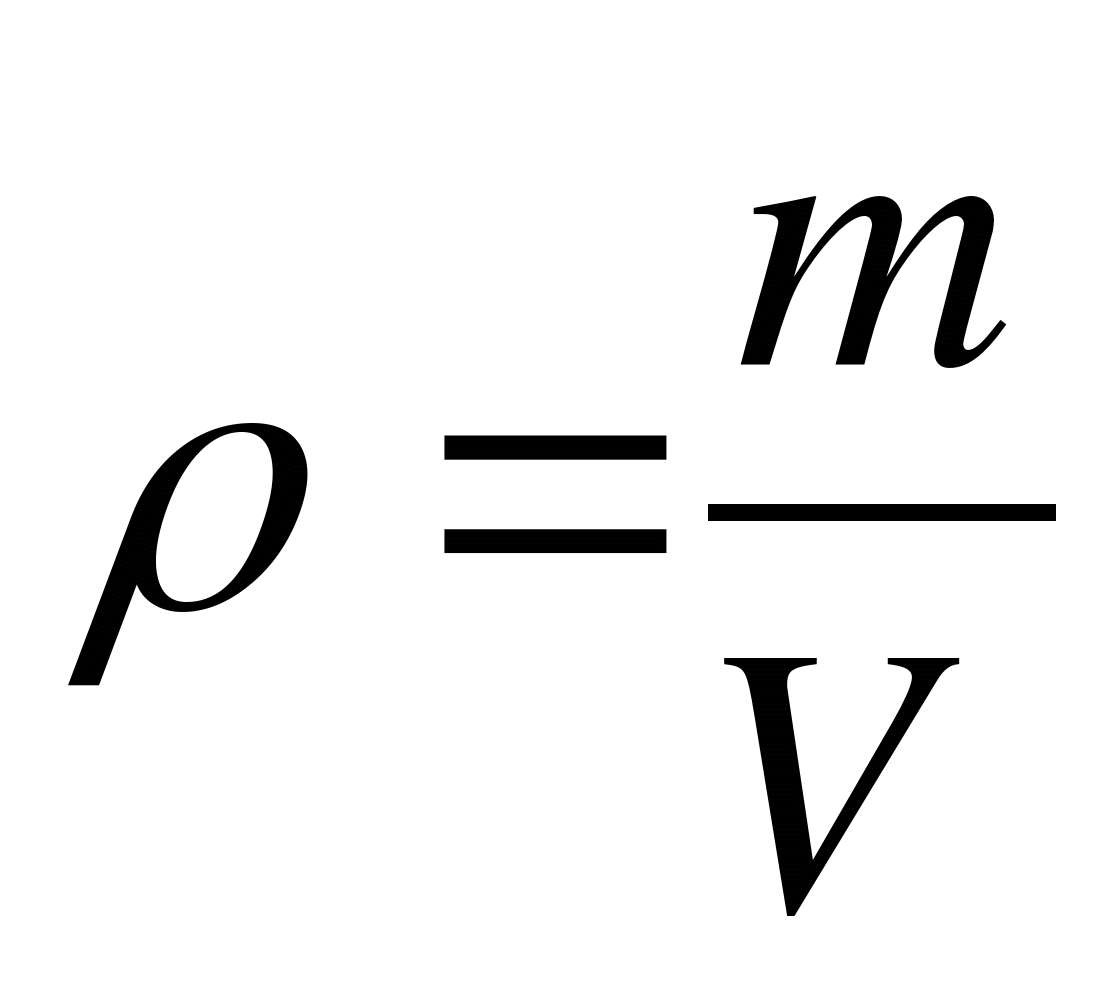 . Б.
. Б. 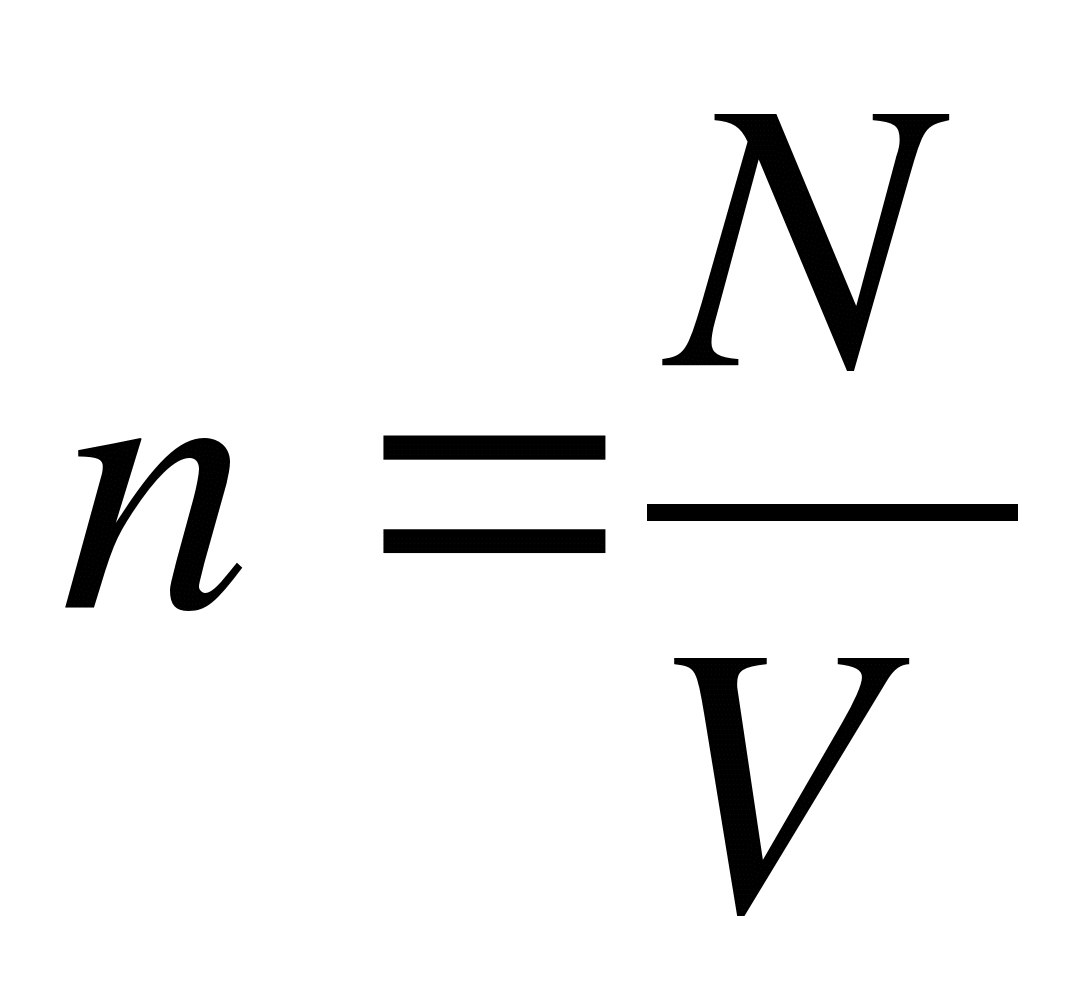 . В.
. В. 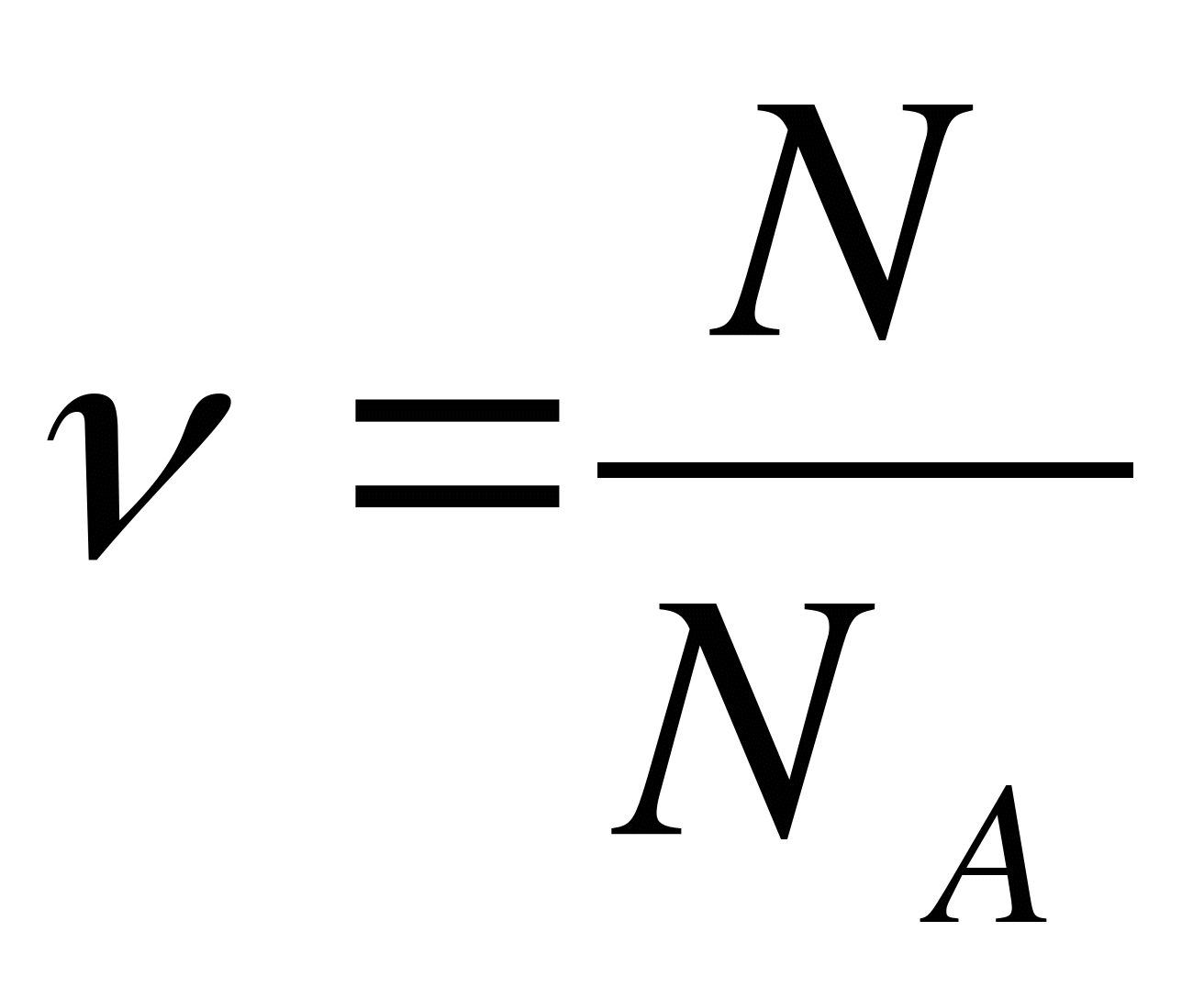 . Г.
. Г. 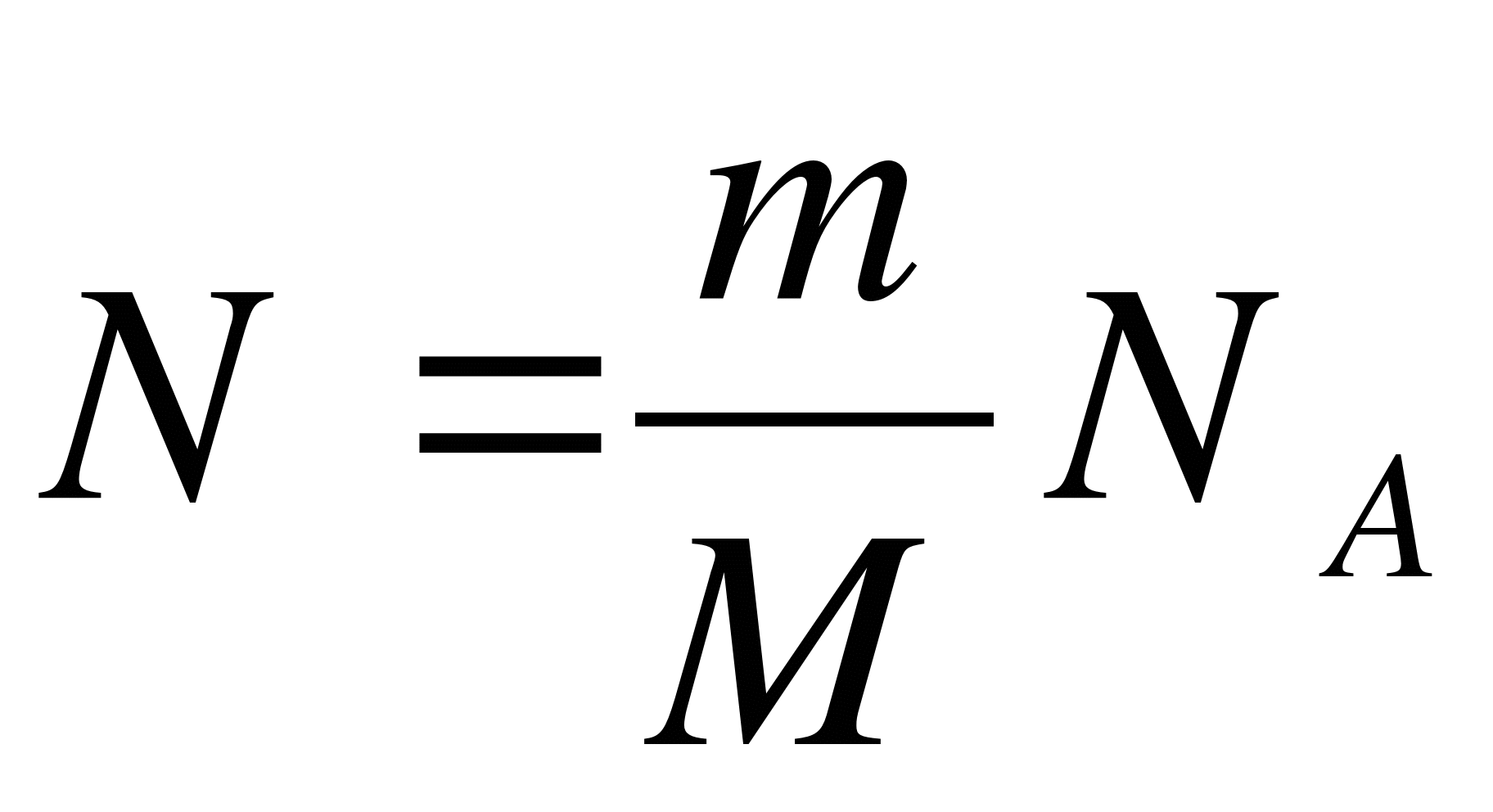 . Д.
. Д. 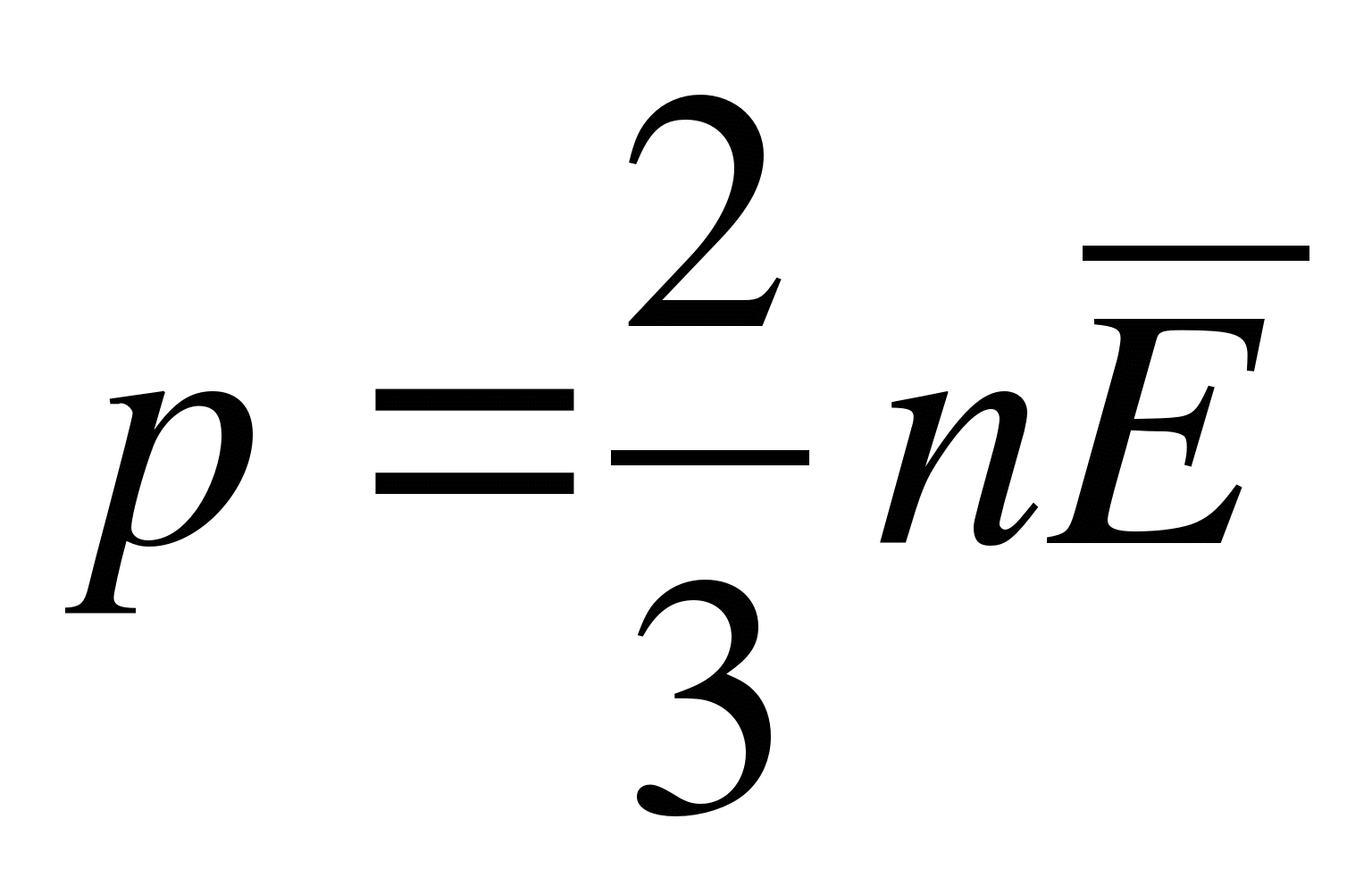 .
.
Как записывается формула связи массы тела с массой молекулы?
А. 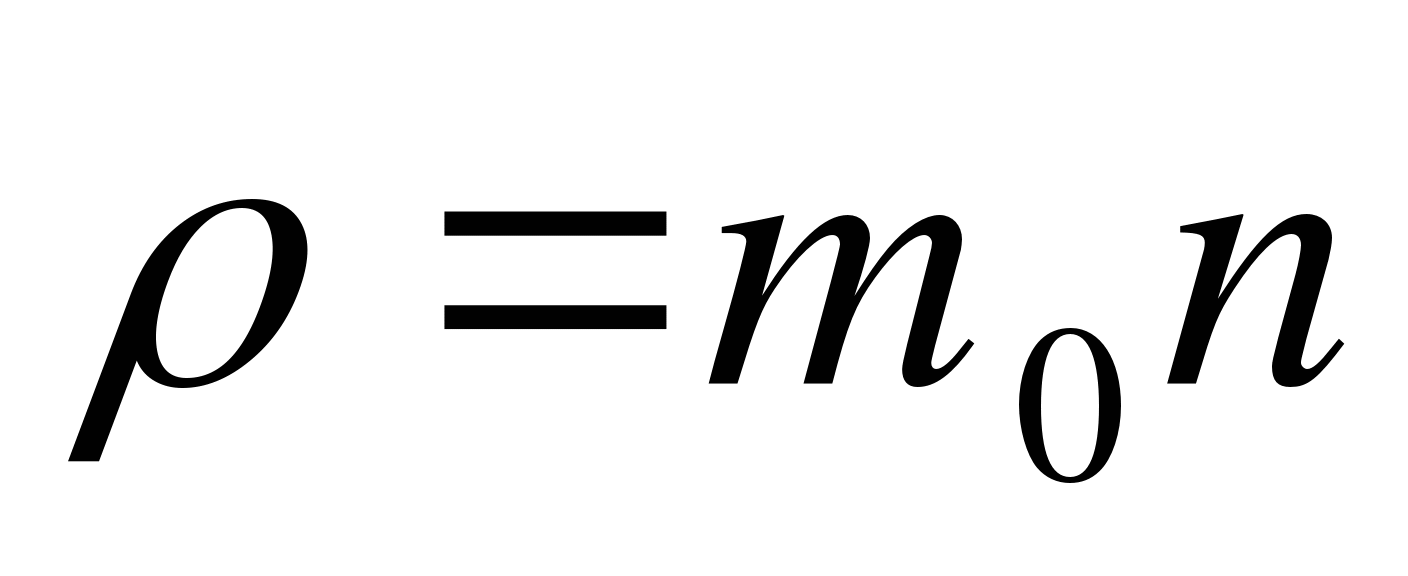 . Б.
. Б. 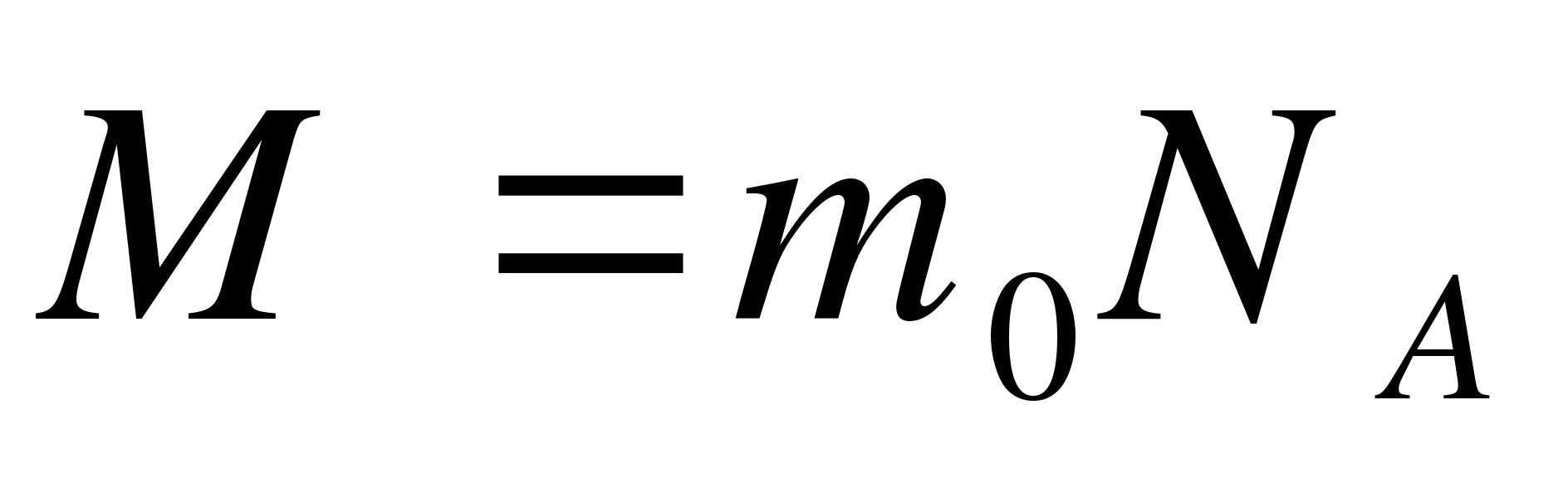 . В.
. В. 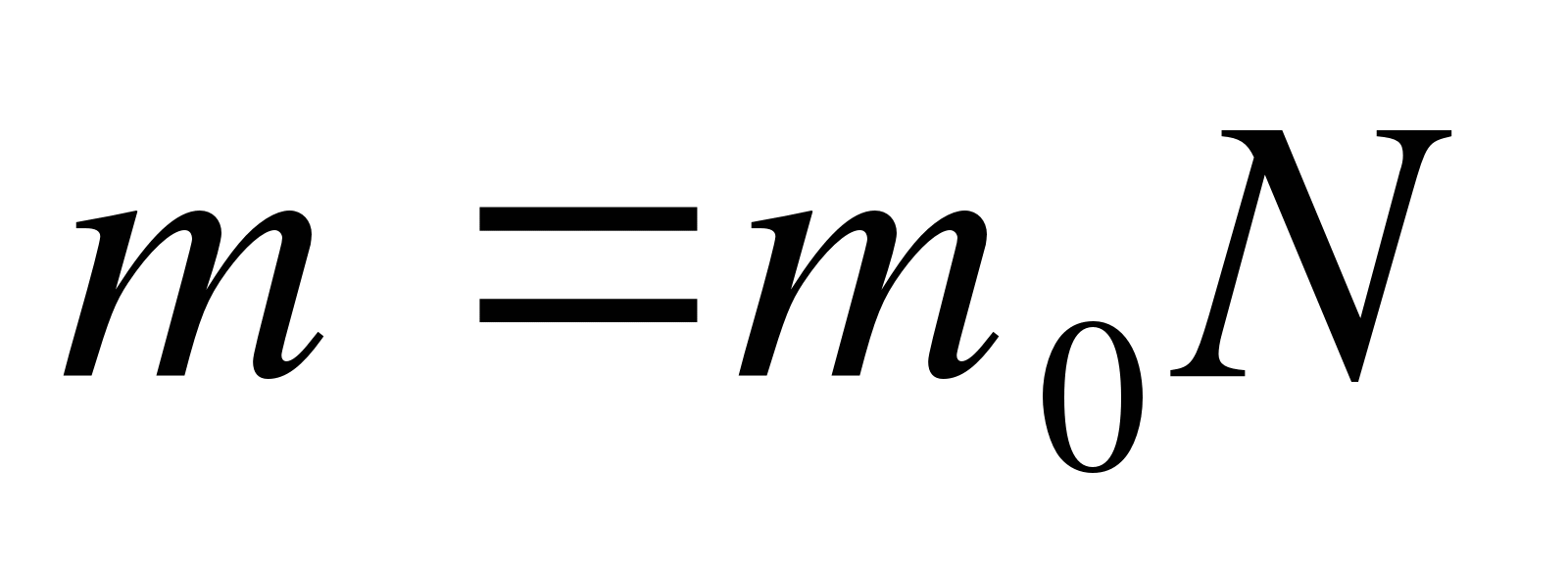 . Г.
. Г. 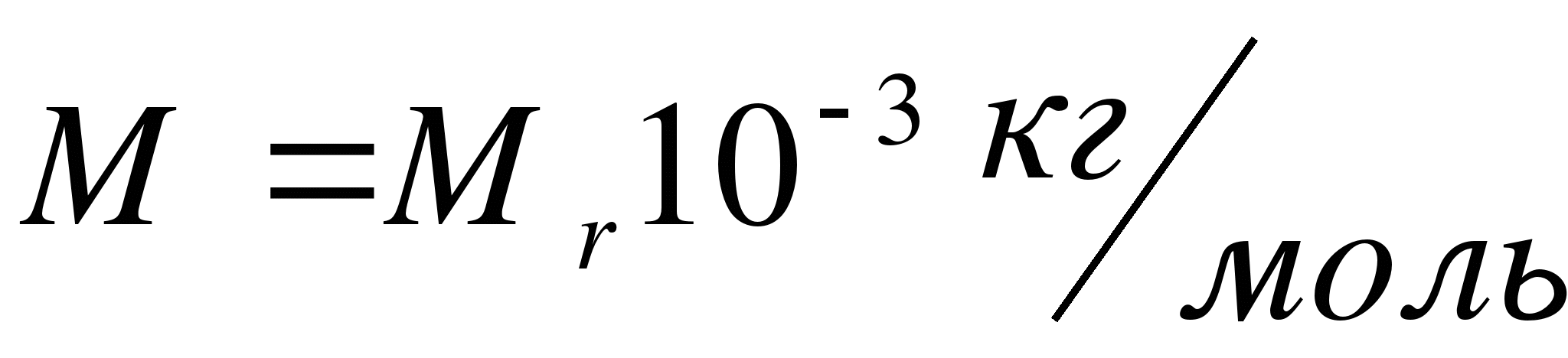 . Д.
. Д. 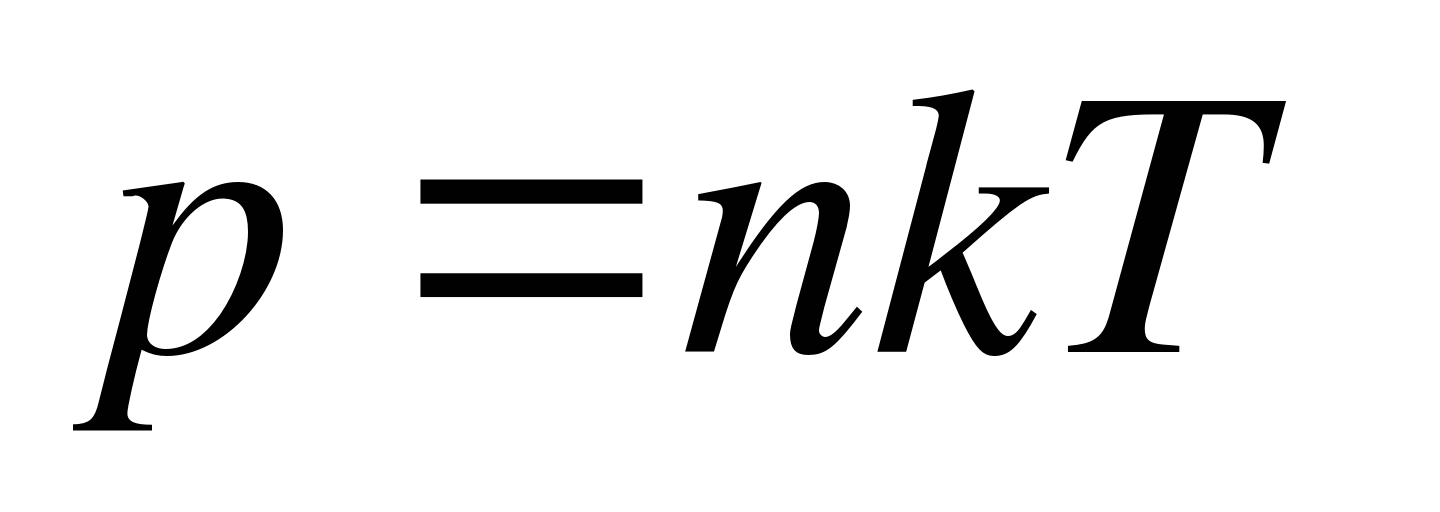 .
.
Тест №3 «Основы МКТ»
Вариант 2
Как обозначается плотность?
А. ρ. Б. m. В. m0. Г. ν. Д. N.
Как обозначается количество вещества?
А. ρ. Б. m. В. m0. Г. ν. Д. N.
Как обозначается давление?
А. NA. Б. p. В. n. Г. 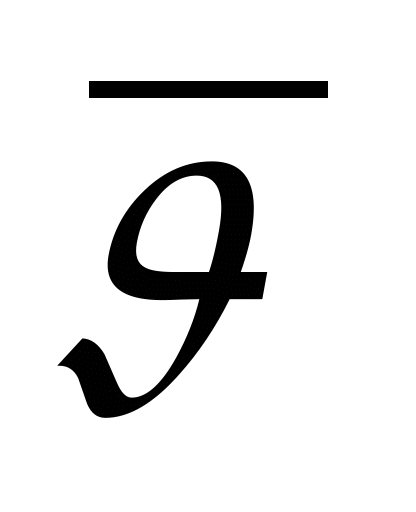 . Д.
. Д. 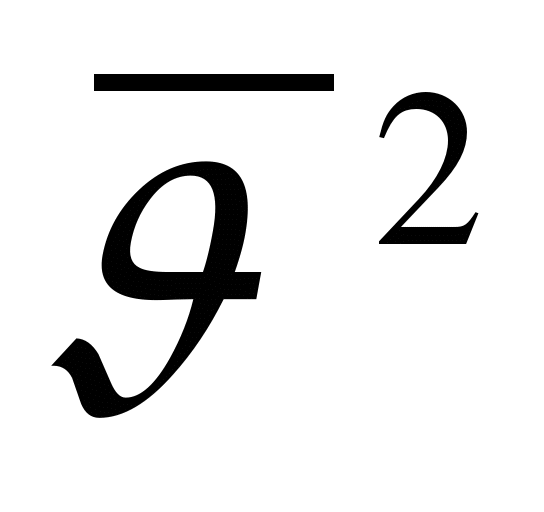 .
.
Как обозначается постоянная Больцмана?
А.  . Б. t. В. T. Г. k. Д. V.
. Б. t. В. T. Г. k. Д. V.
Как обозначается температура по шкале Кельвина?
А.  . Б. t. В. T. Г. k. Д. V.
. Б. t. В. T. Г. k. Д. V.
Как обозначается молярная масса?
А. R. Б. Мr. В. М T. Г. k. Д. V.
Как обозначается объем?
А.  . Б. t. В. T. Г. k. Д. V.
. Б. t. В. T. Г. k. Д. V.
В каких единицах измеряется концентрация?
А. Па. Б. м/с. В. м2/с2. Г. 1/м3. Д. Дж.
В каких единицах измеряется давление?
А. Па. Б. м/с. В. м2/с2. Г. 1/м3. Д. Дж.
В каких единицах измеряется средняя квадратичная скорость?
А. Па. Б. м/с. В. м2/с2. Г. 1/м3. Д. Дж.
Как записывается формула связи молярной массы с массой молекулы?
А. 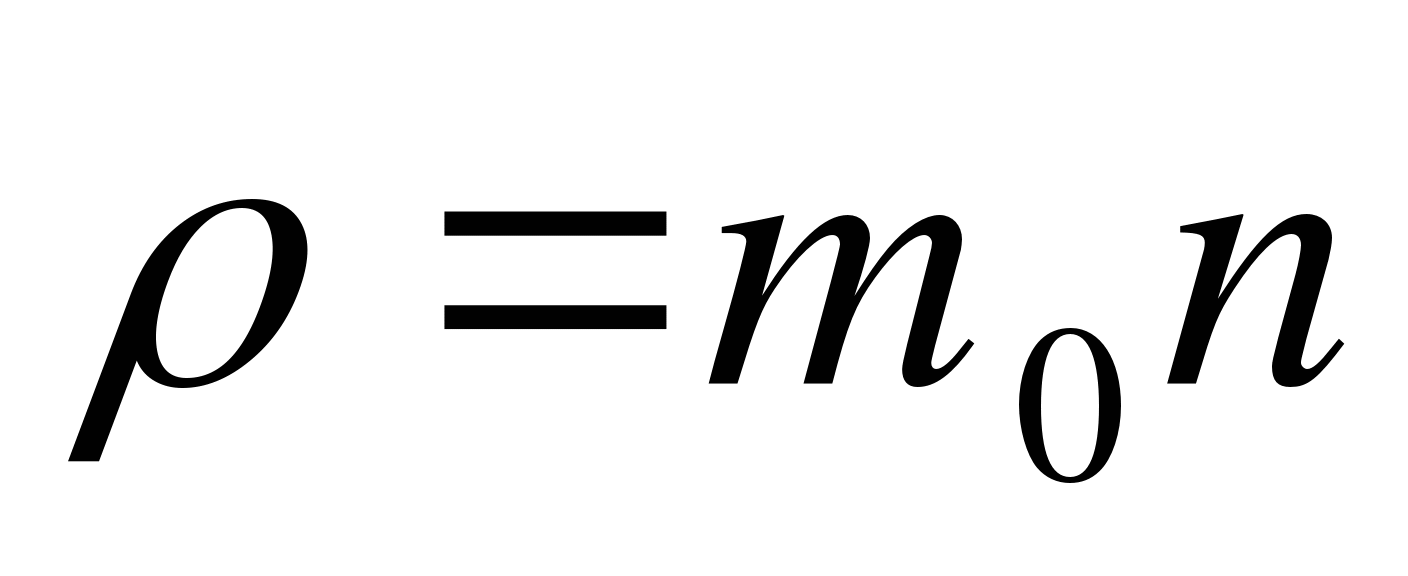 . Б.
. Б. 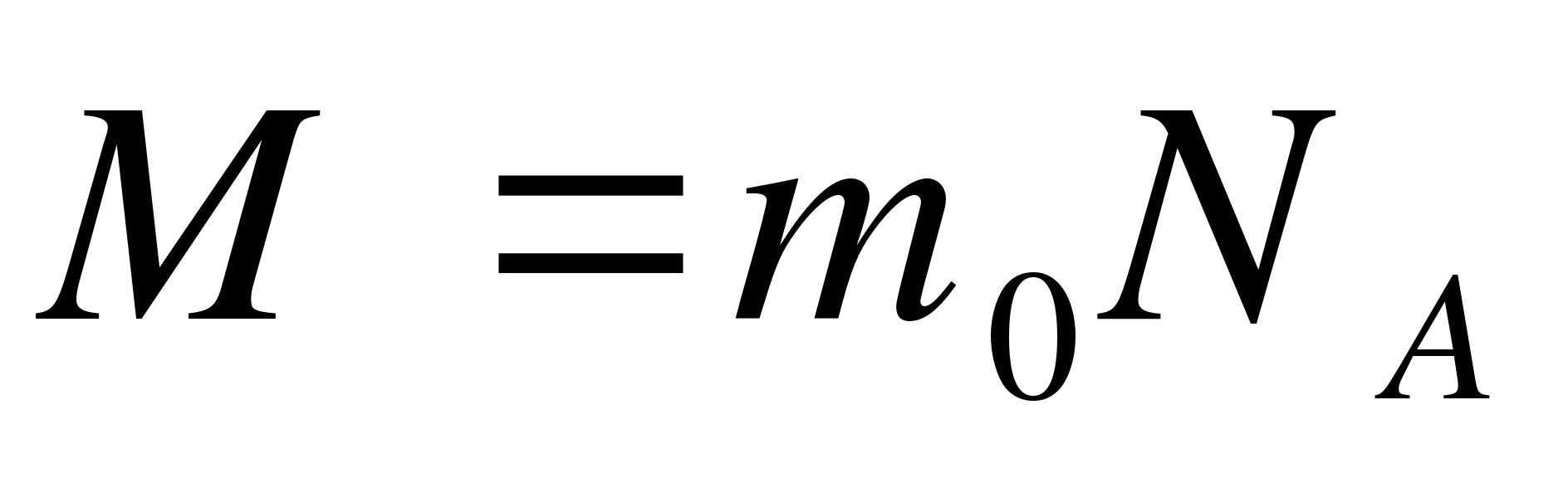 . В.
. В. 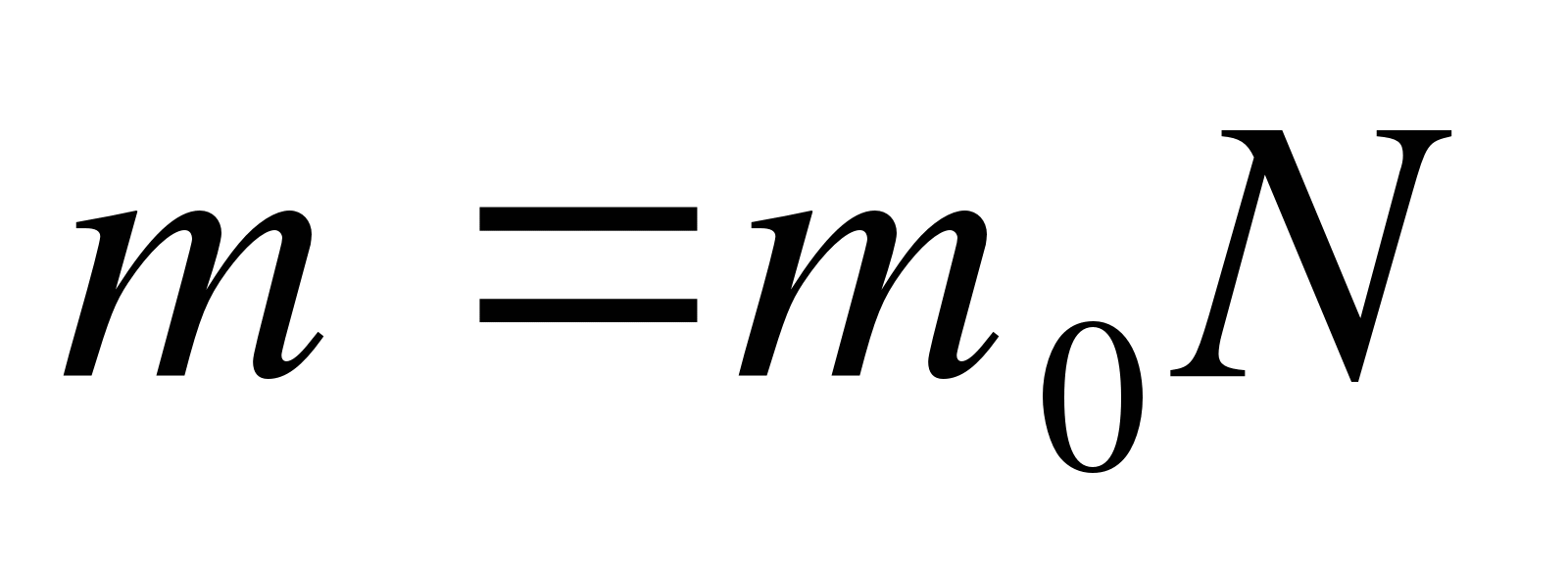 . Г.
. Г. 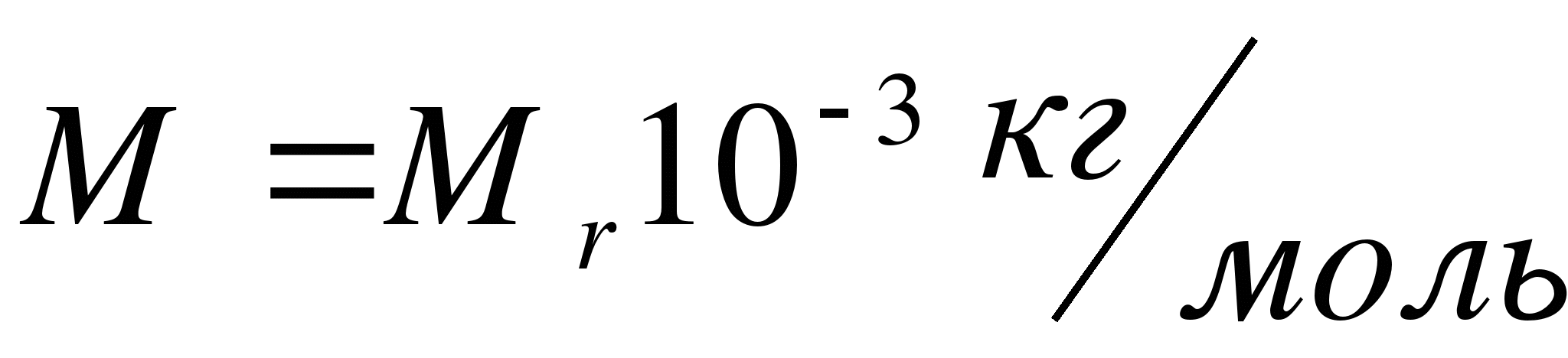 . Д.
. Д. 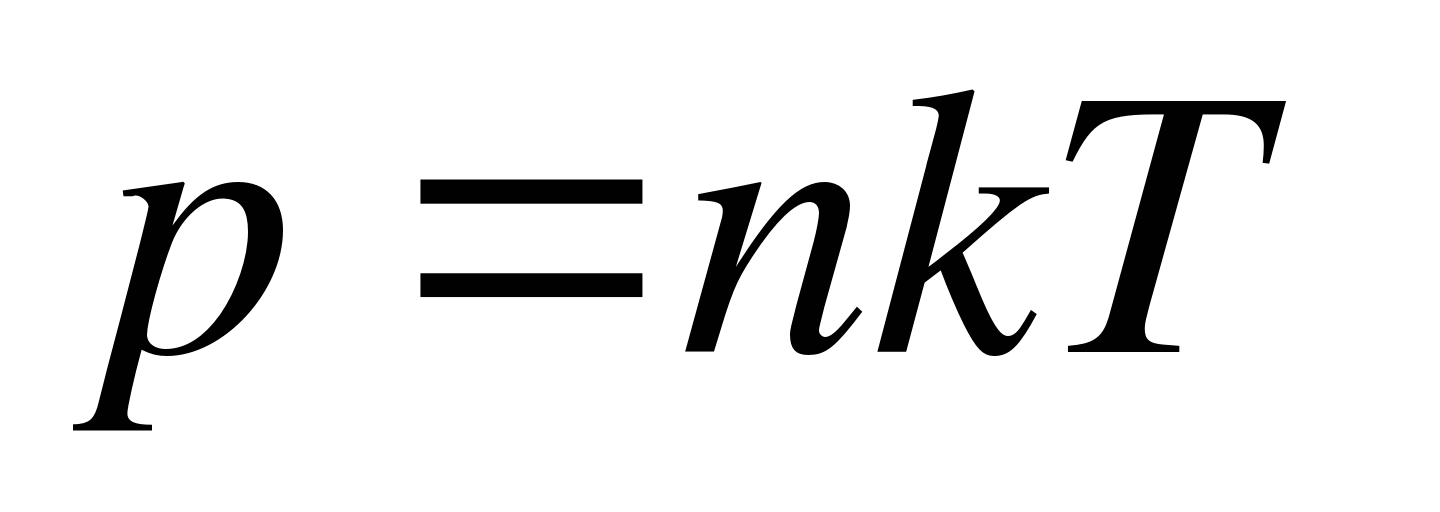 .
.
Как записывается уравнение состояния идеального газа?
А. 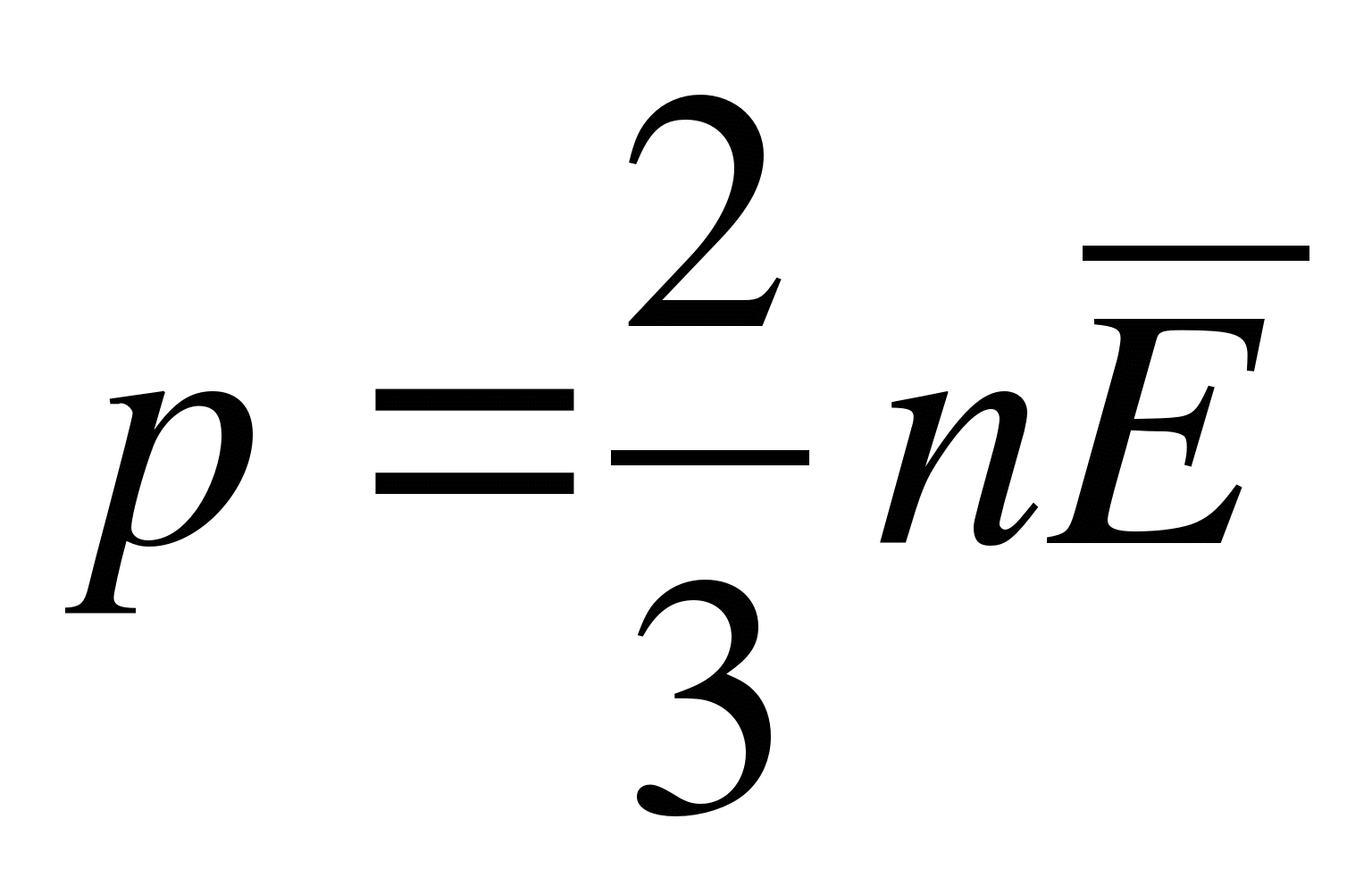 . Б.
. Б. 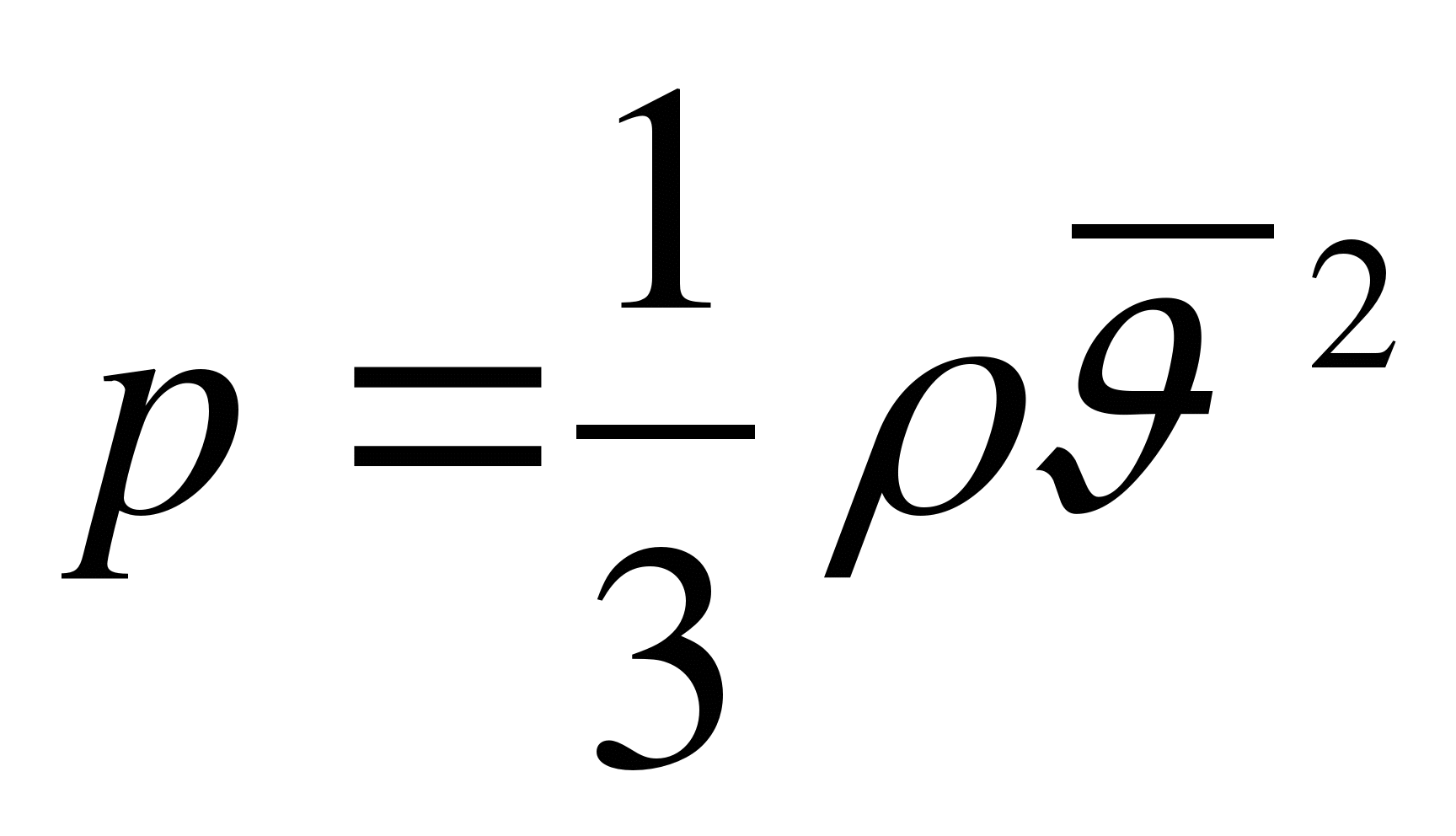 . В.
. В. 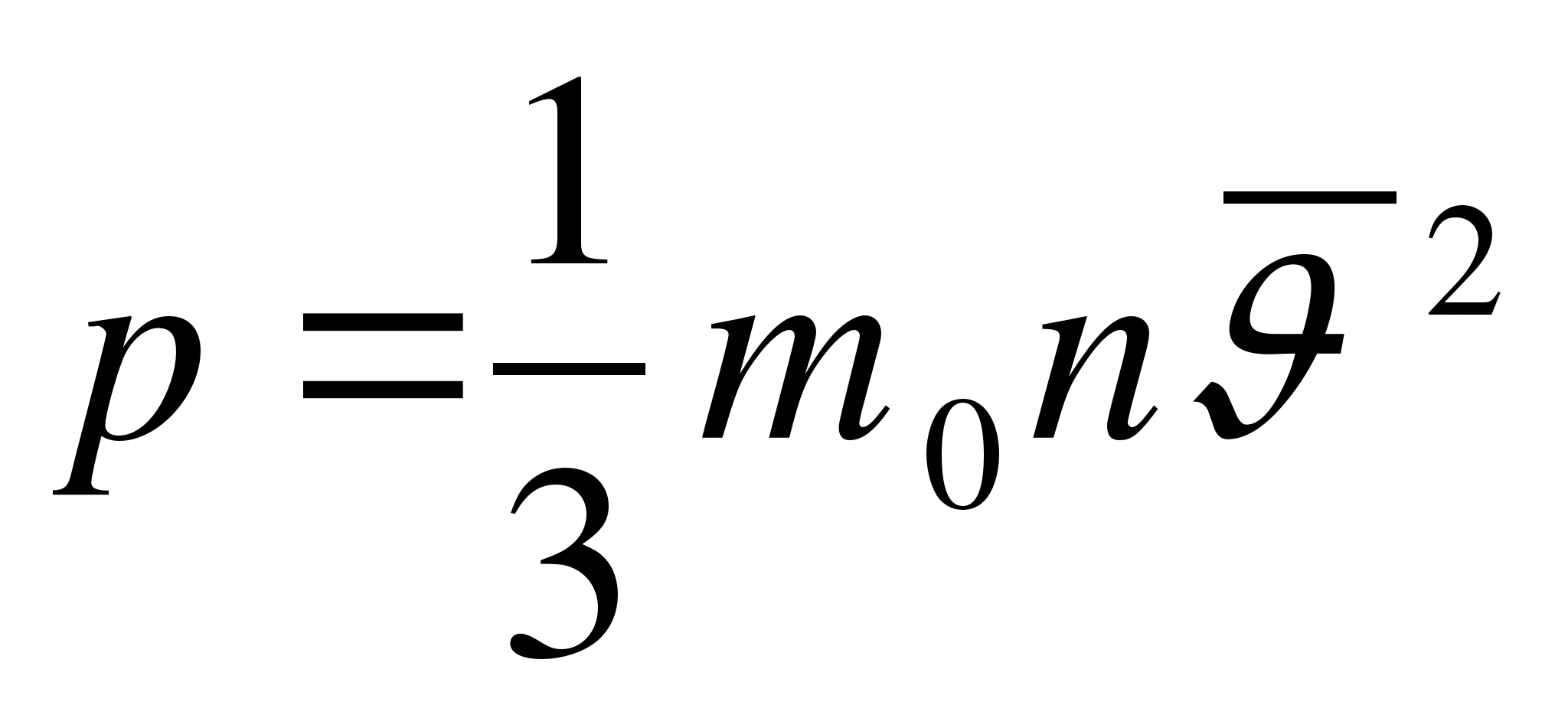 . Г.
. Г. 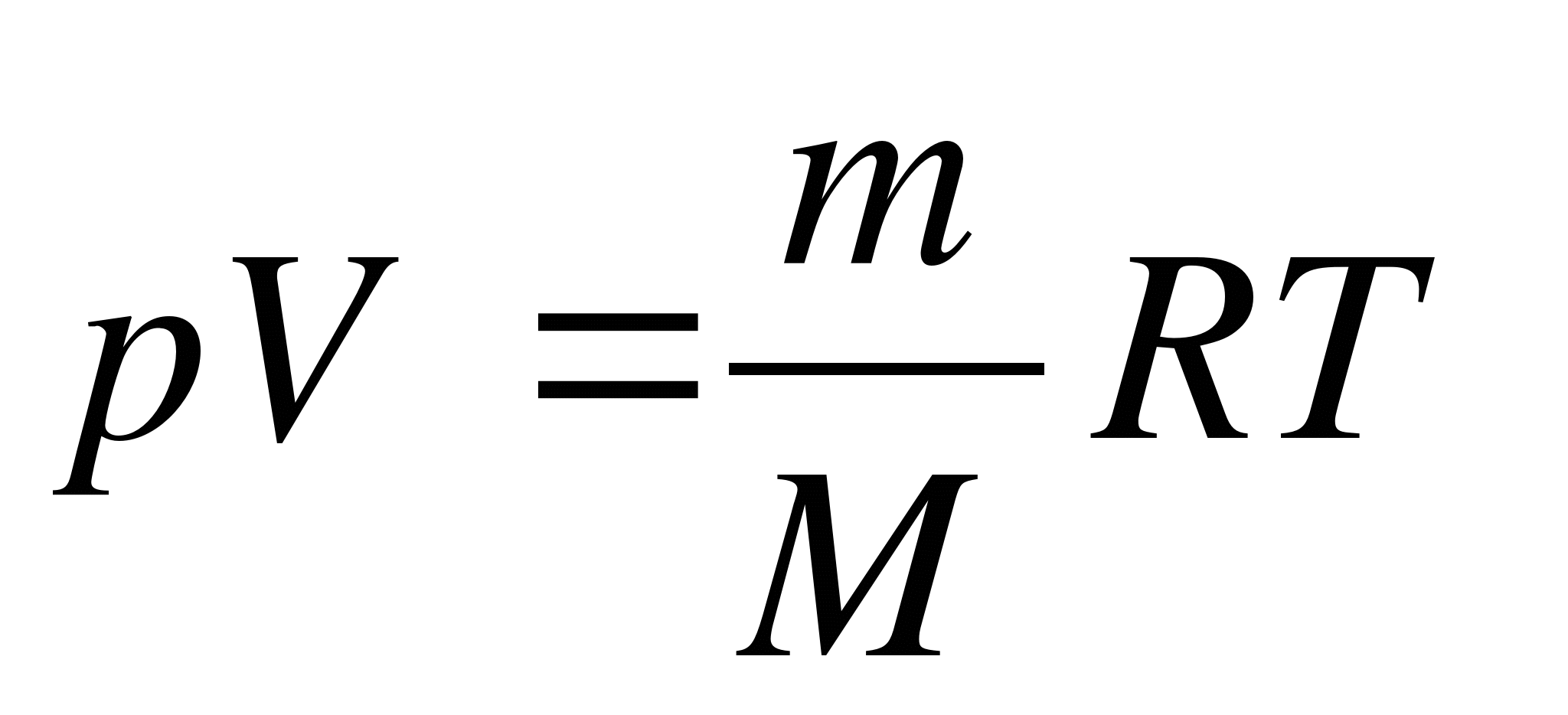 . Д.
. Д. 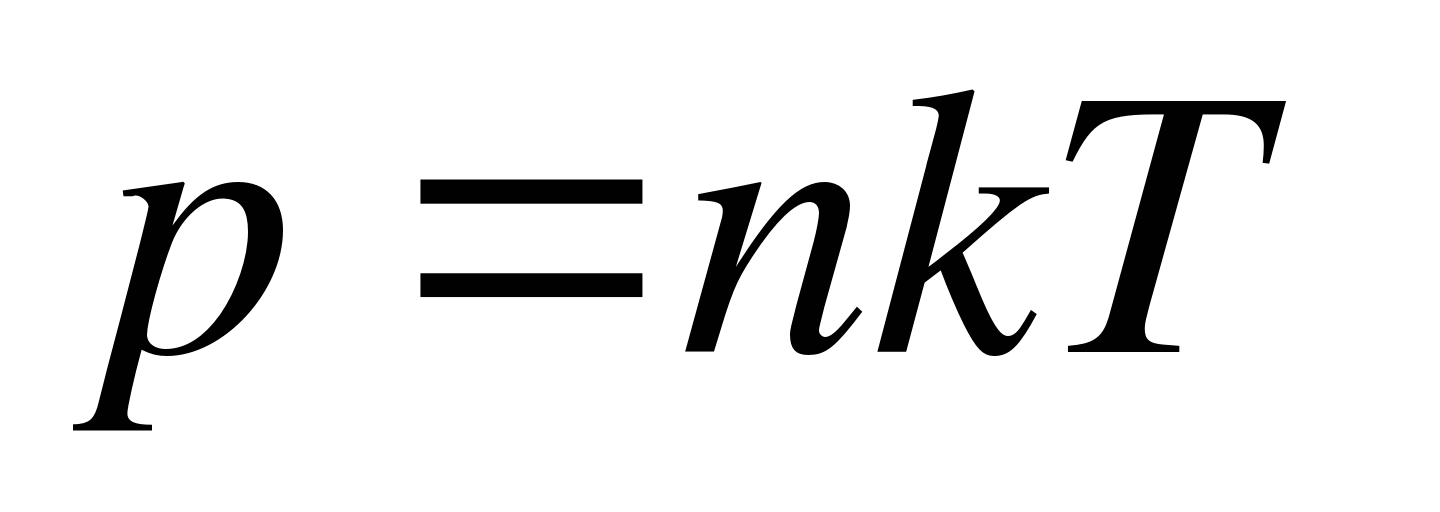 .
.
Как записывается формула закона Шарля?
А. 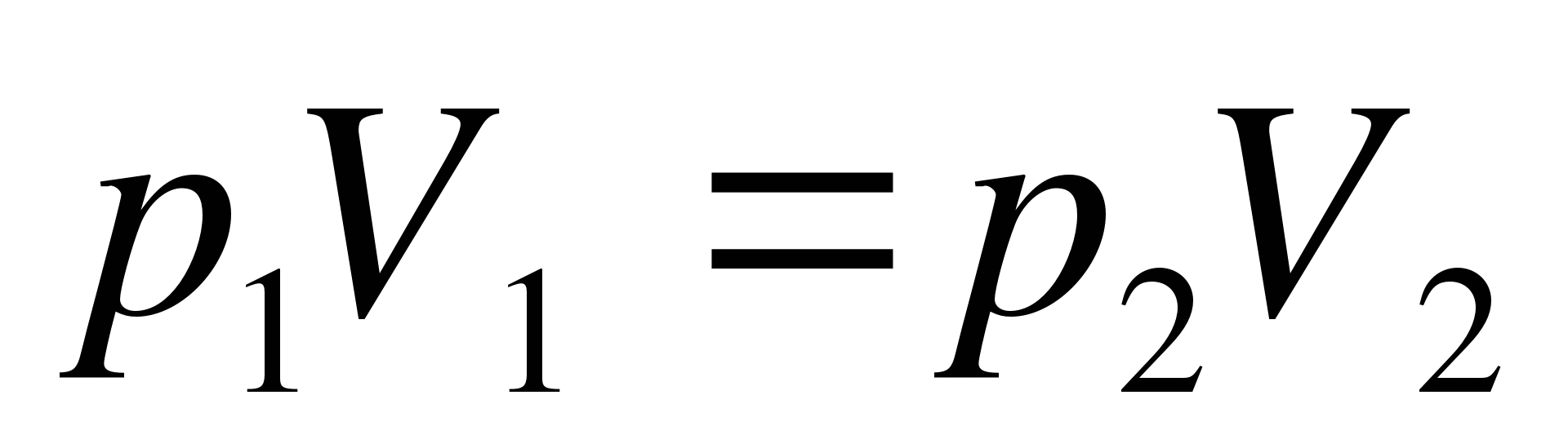 . Б.
. Б. 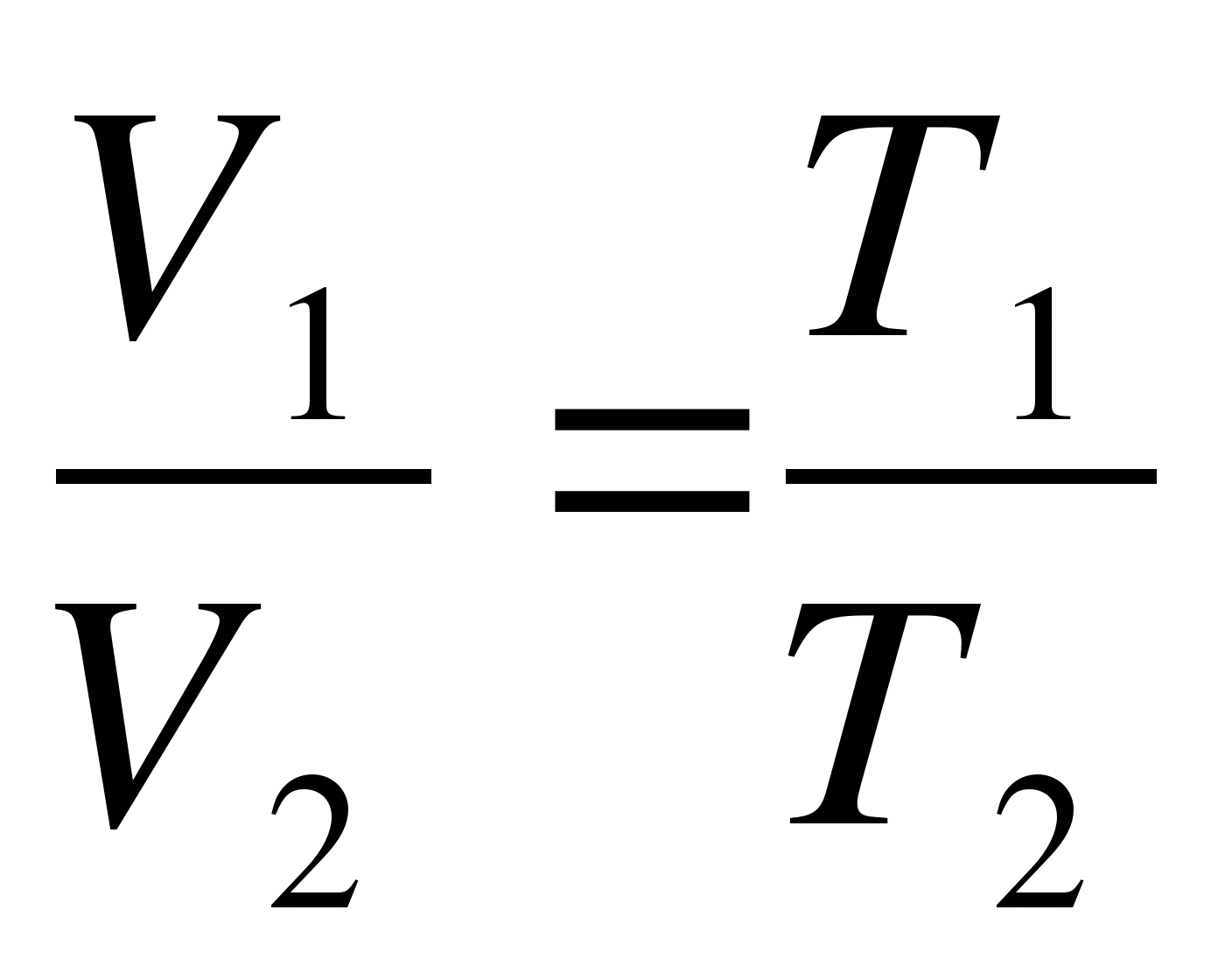 . В.
. В. 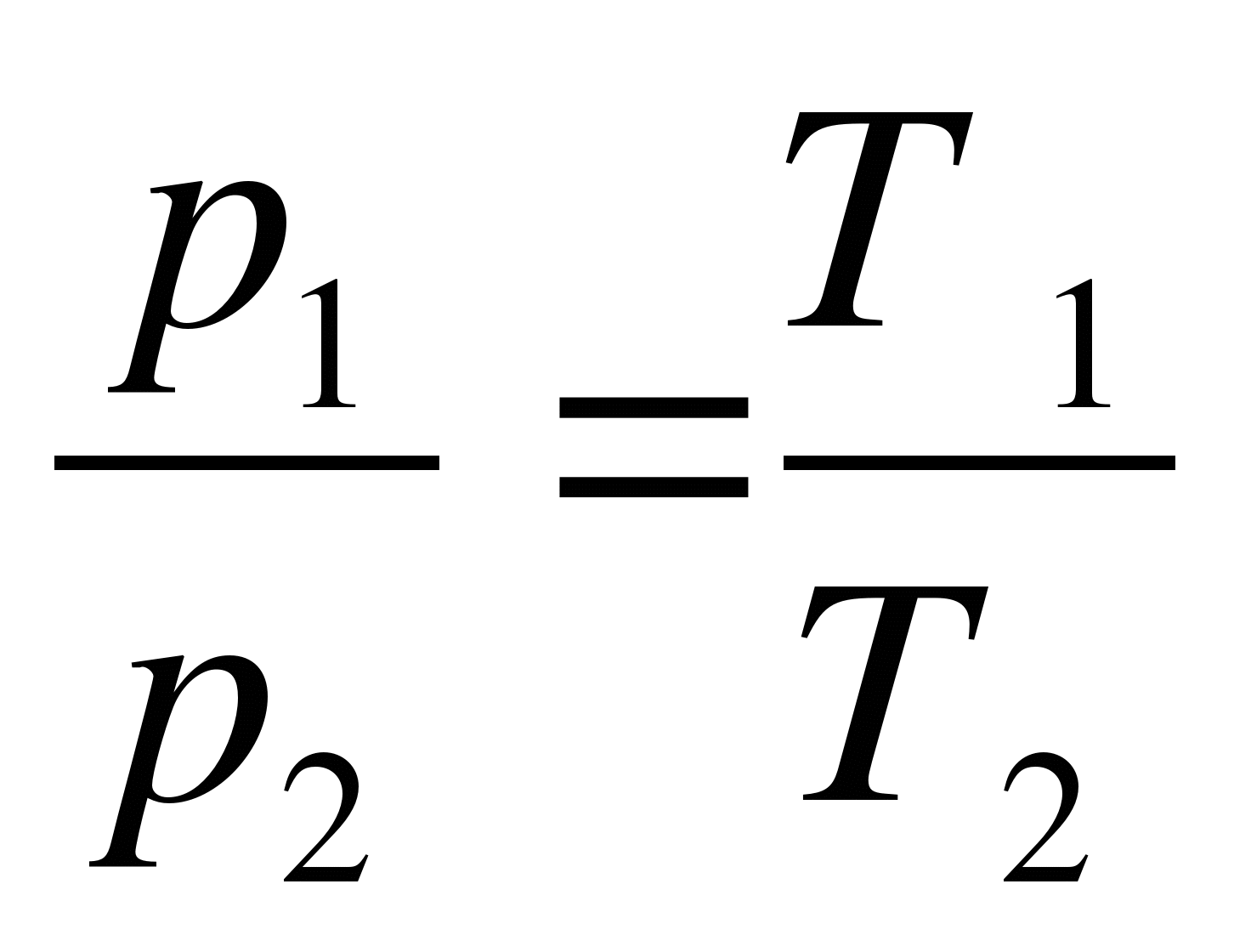 . Г.
. Г. 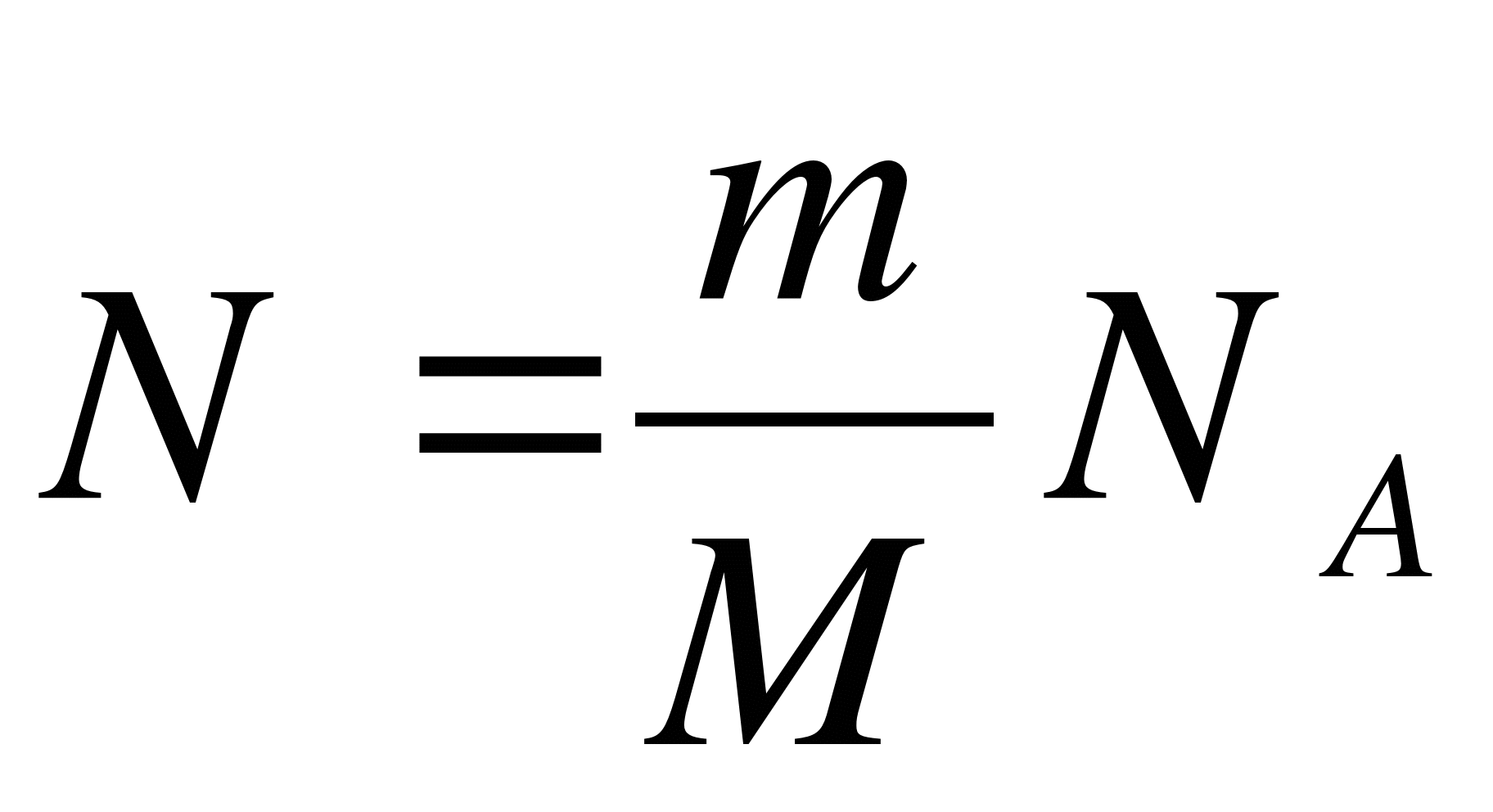 . Д.
. Д. 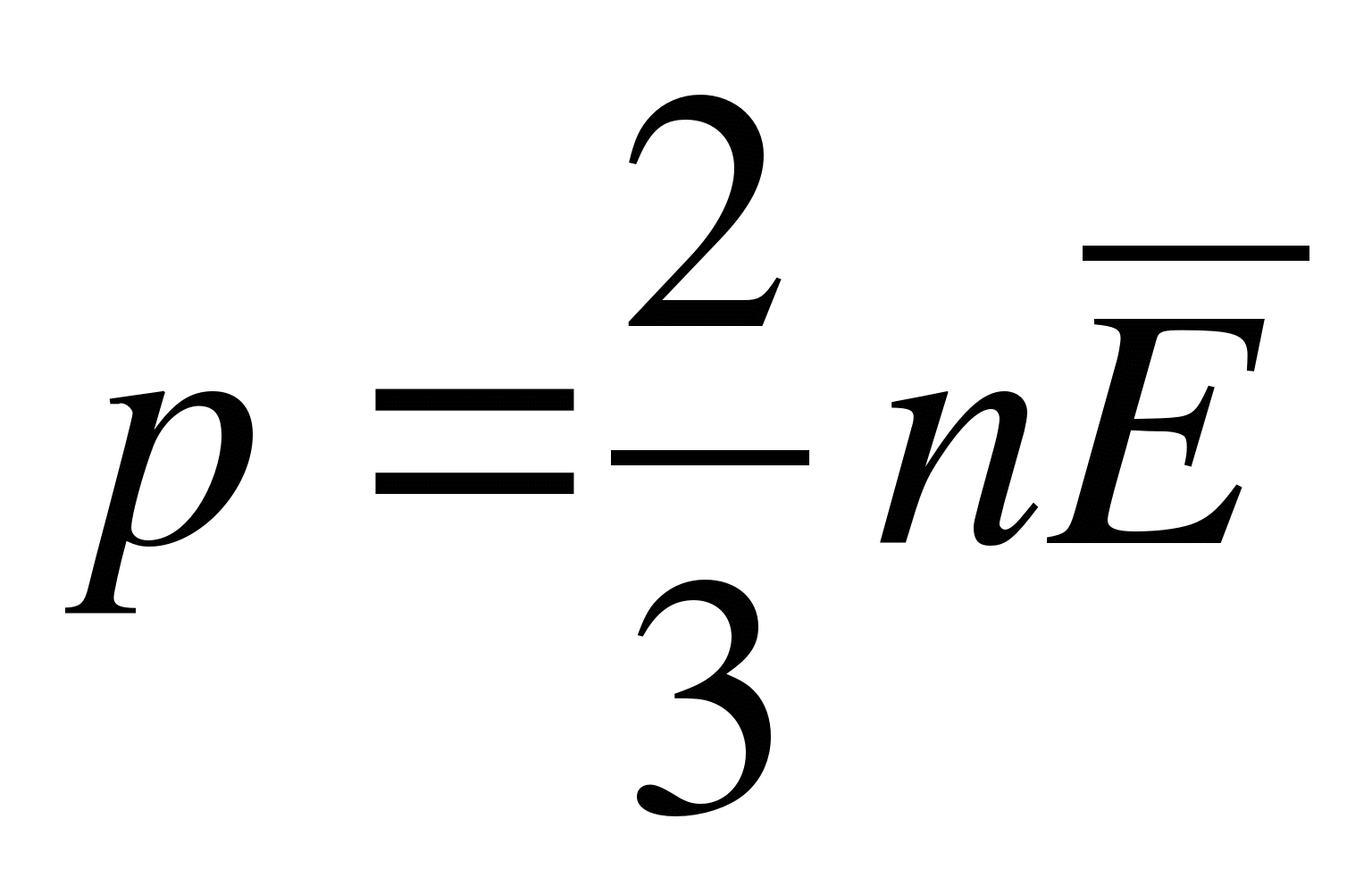 .
.
Какой закон справедлив для изобарного процесса?
А. Гука. Б. Бойля-Мариотта. В. Гей-Люссака. Г. Шарля. Д. Нет правильного ответа.
Как записывается формула закона Бойля — Мариотта?
А. 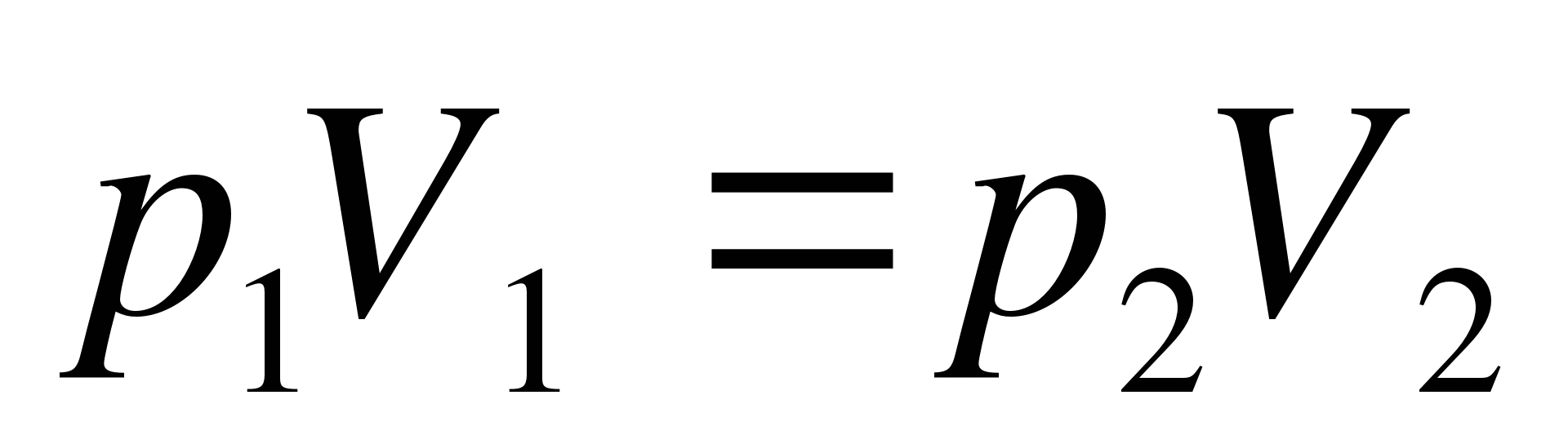 . Б.
. Б. 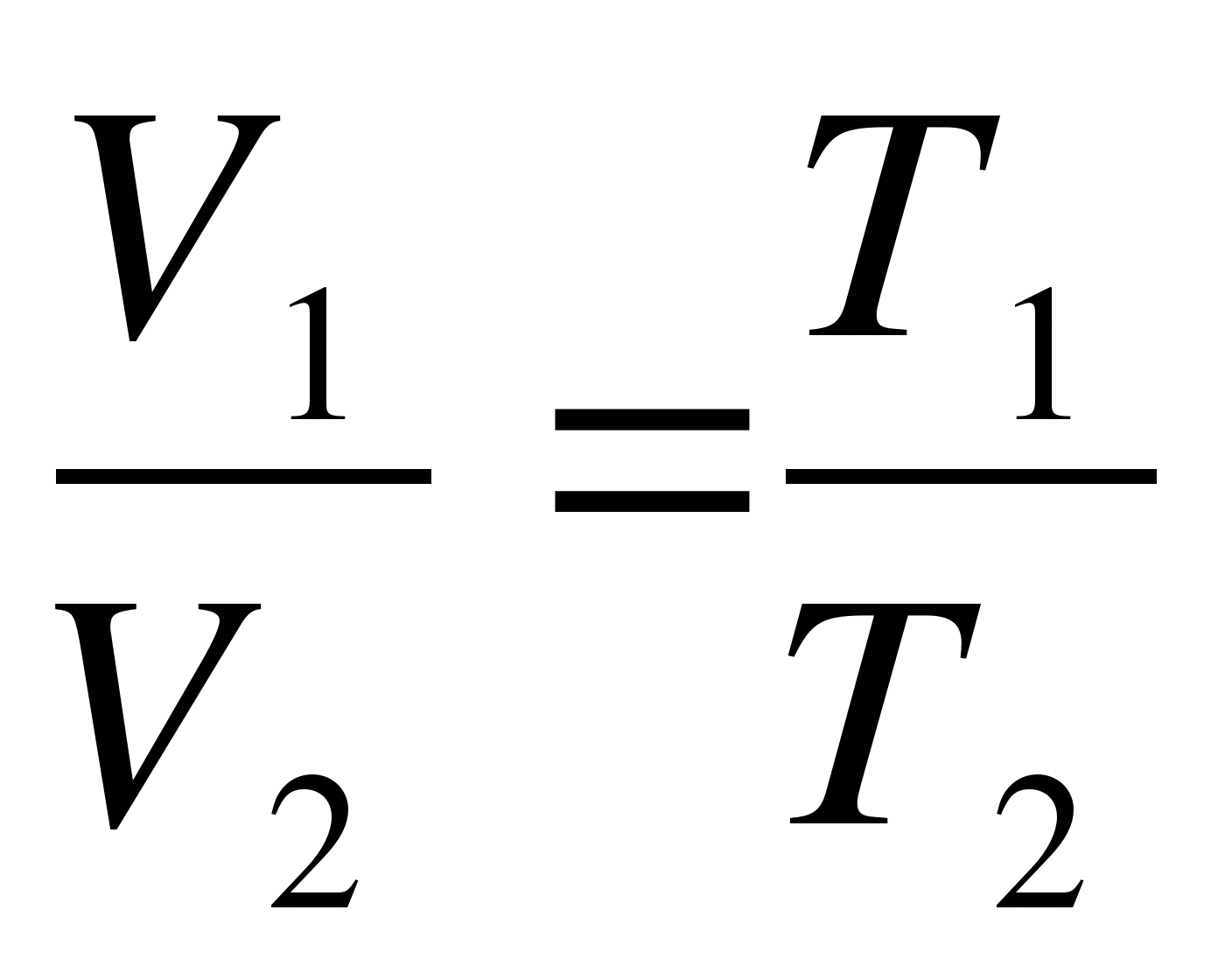 . В.
. В. 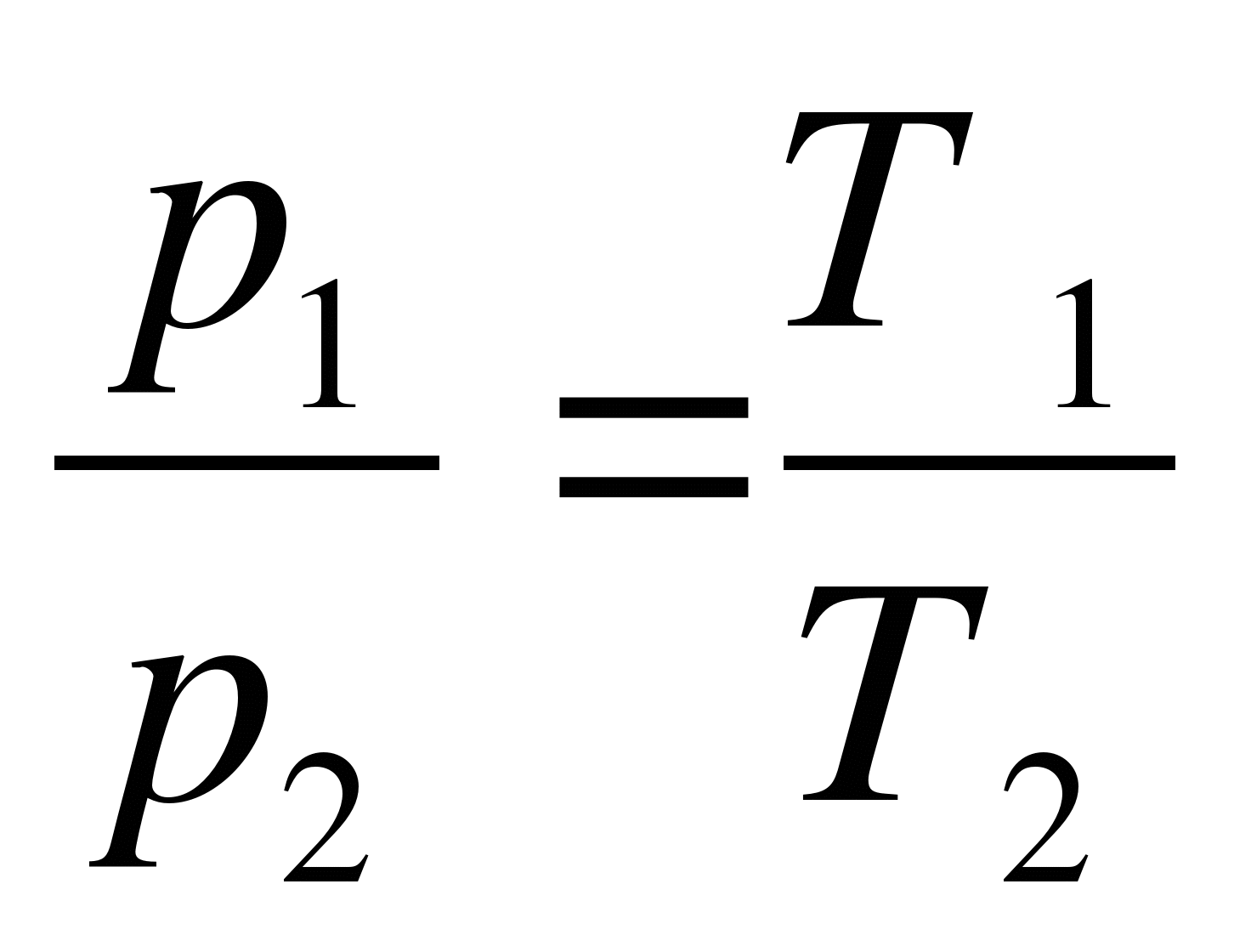 . Г.
. Г. 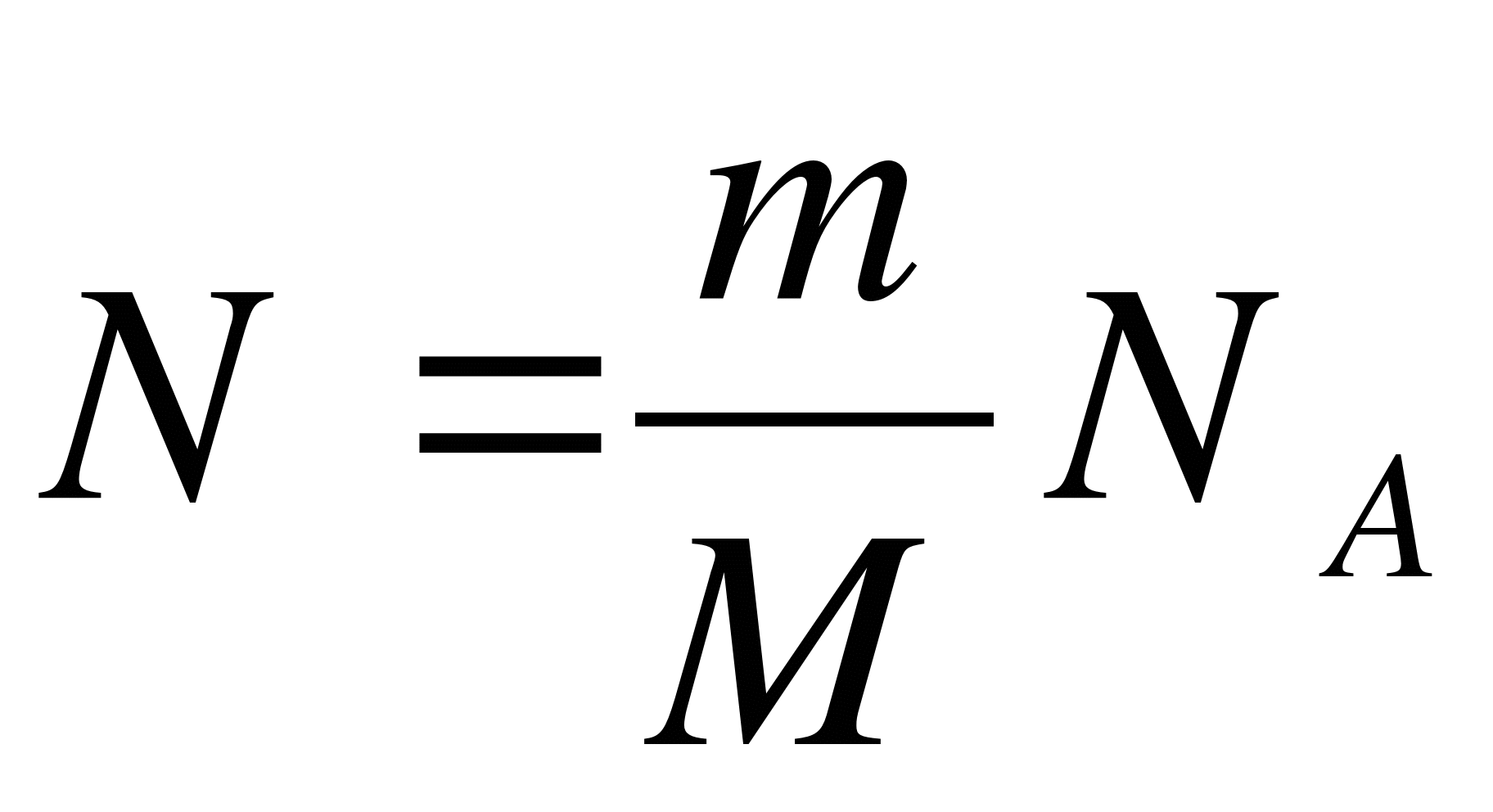 . Д.
. Д. 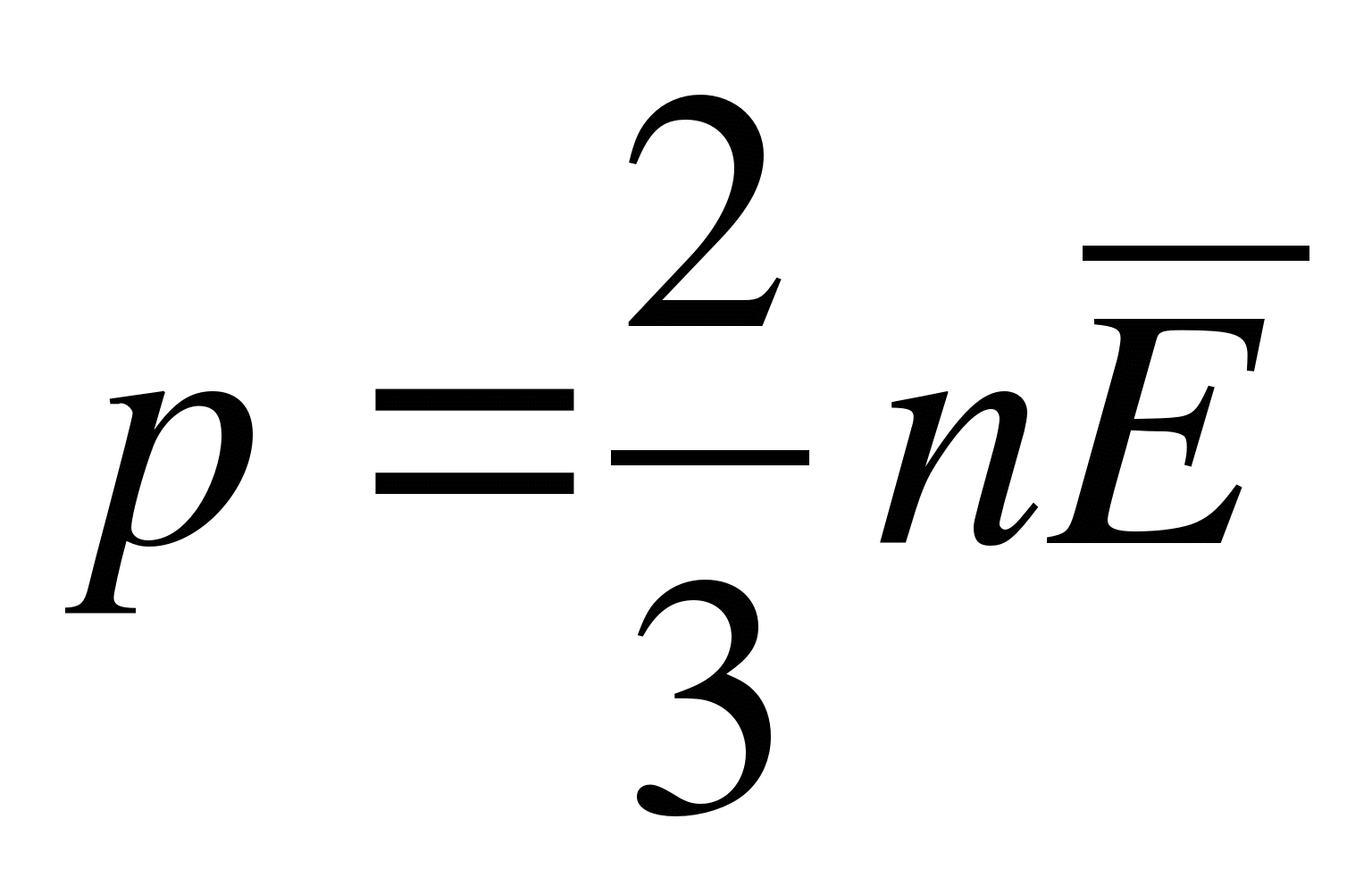 .
.
Какой закон справедлив для изотермического процесса?
А. Гука. Б. Бойля-Мариотта. В. Гей-Люссака. Г. Шарля. Д. нет правильного.
При повышении температуры газа в запаянном сосуде его давление увеличивается. Это объясняется тем, что с повышением температуры:
А) Увеличиваются размеры молекул газа;
Б) Увеличивается энергия движения молекул газа;
В) Увеличивается потенциальная энергия молекул газа;
Г) Расширяется сосуд (увеличивается его объём)
Найдите среднюю кинетическую энергию поступательного движения молекул гелия, если при давлении 0,5*105Па их концентрация n=1,5*109m-3
33. Какое количество вещества содержится в железной отливке массой 5,6кг?
Как записывается формула связи плотности с концентрацией?
А. 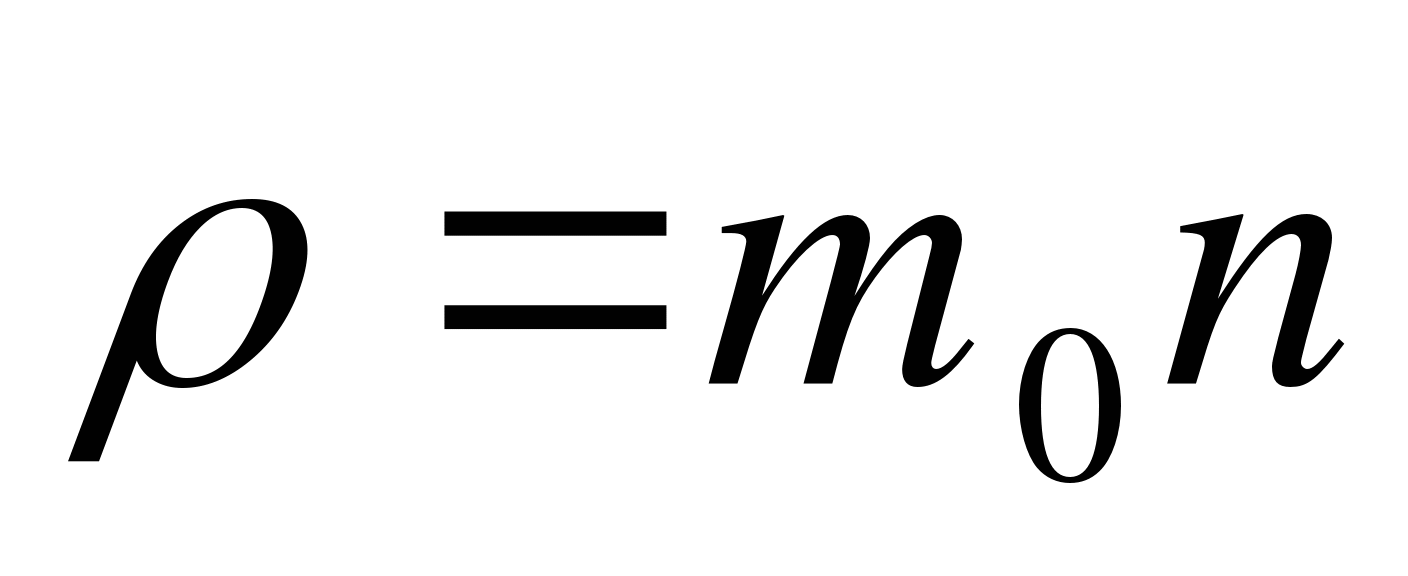 . Б.
. Б. 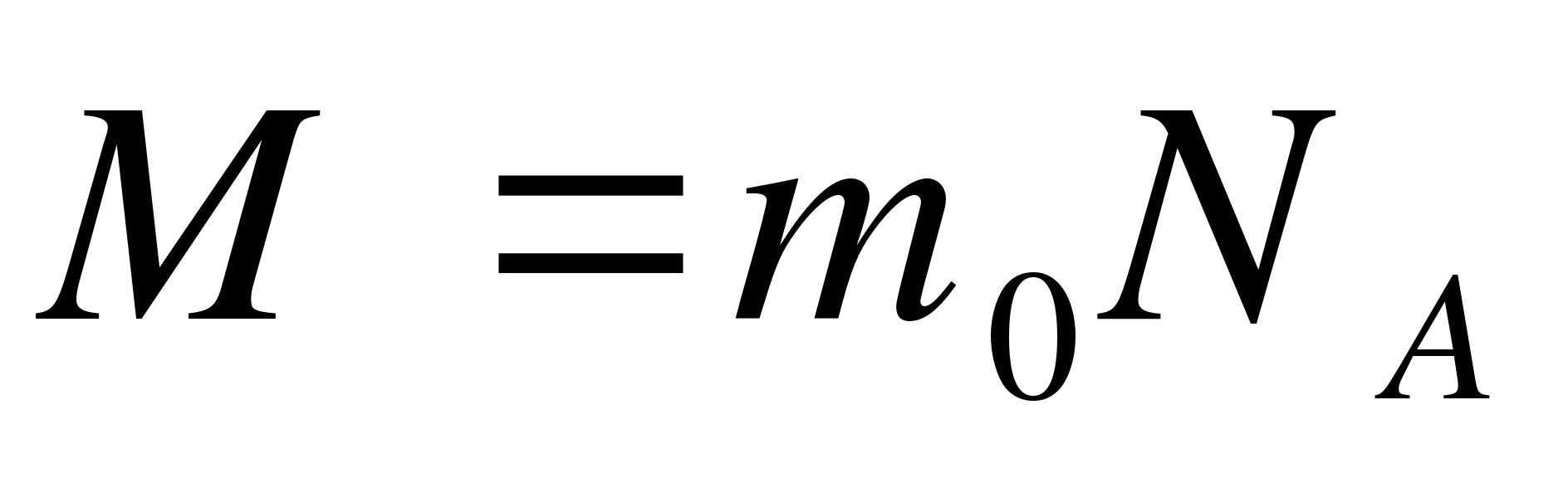 . В.
. В. 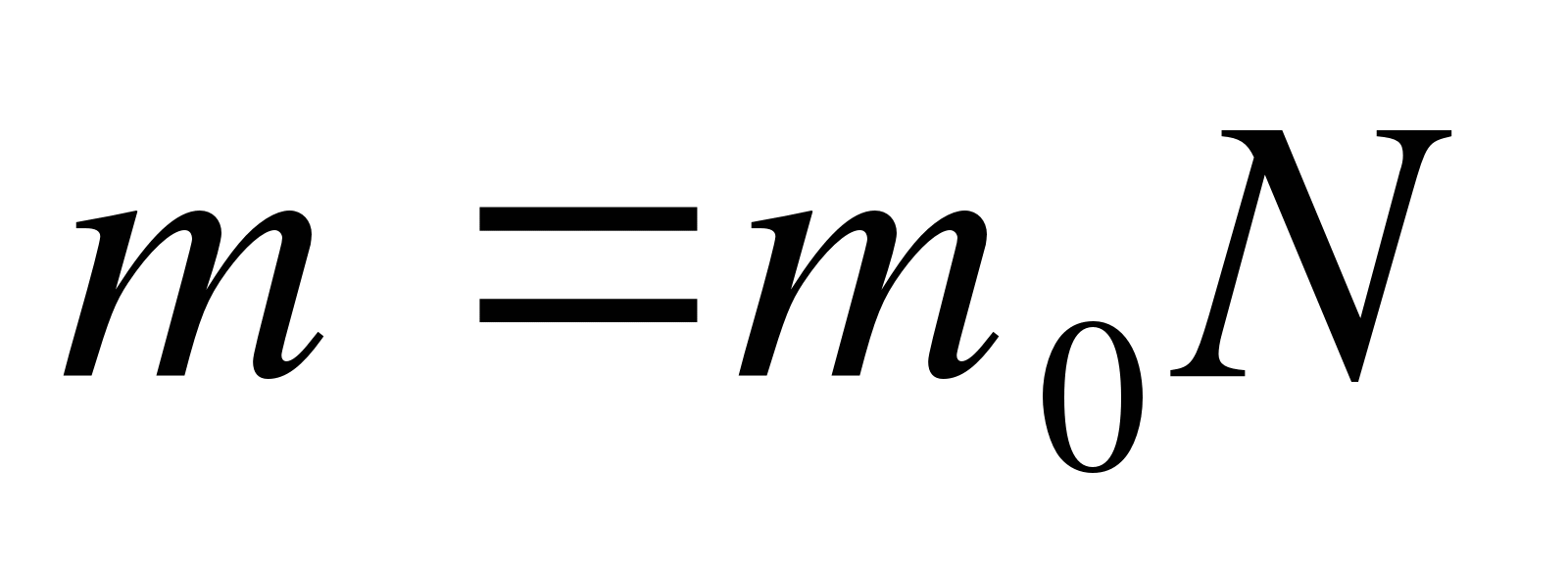 . Г.
. Г. 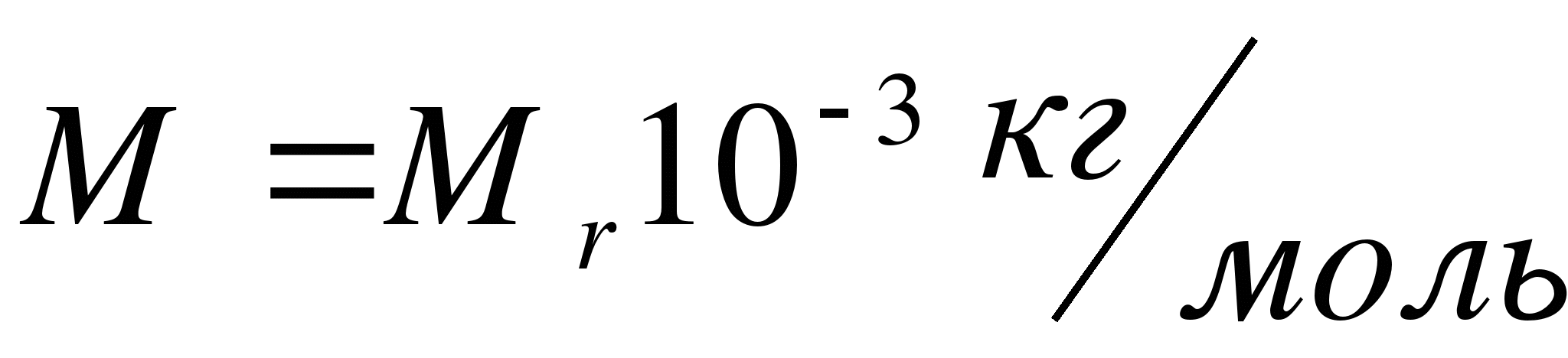 . Д.
. Д. 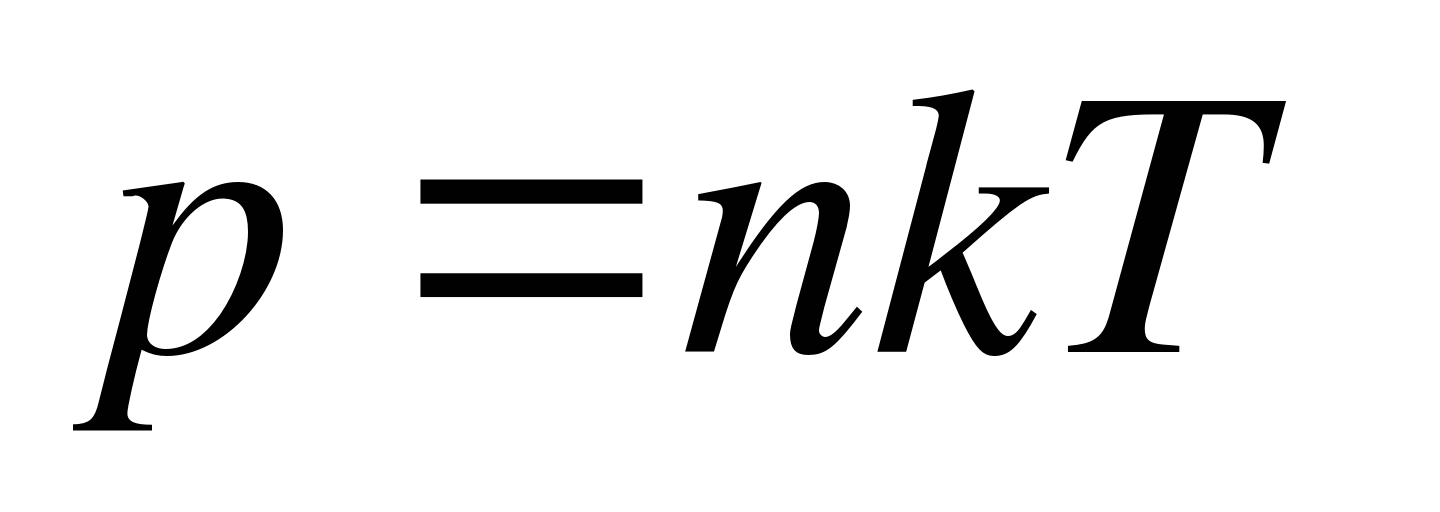 .
.
Как записывается формула для определения количества вещества?
А. 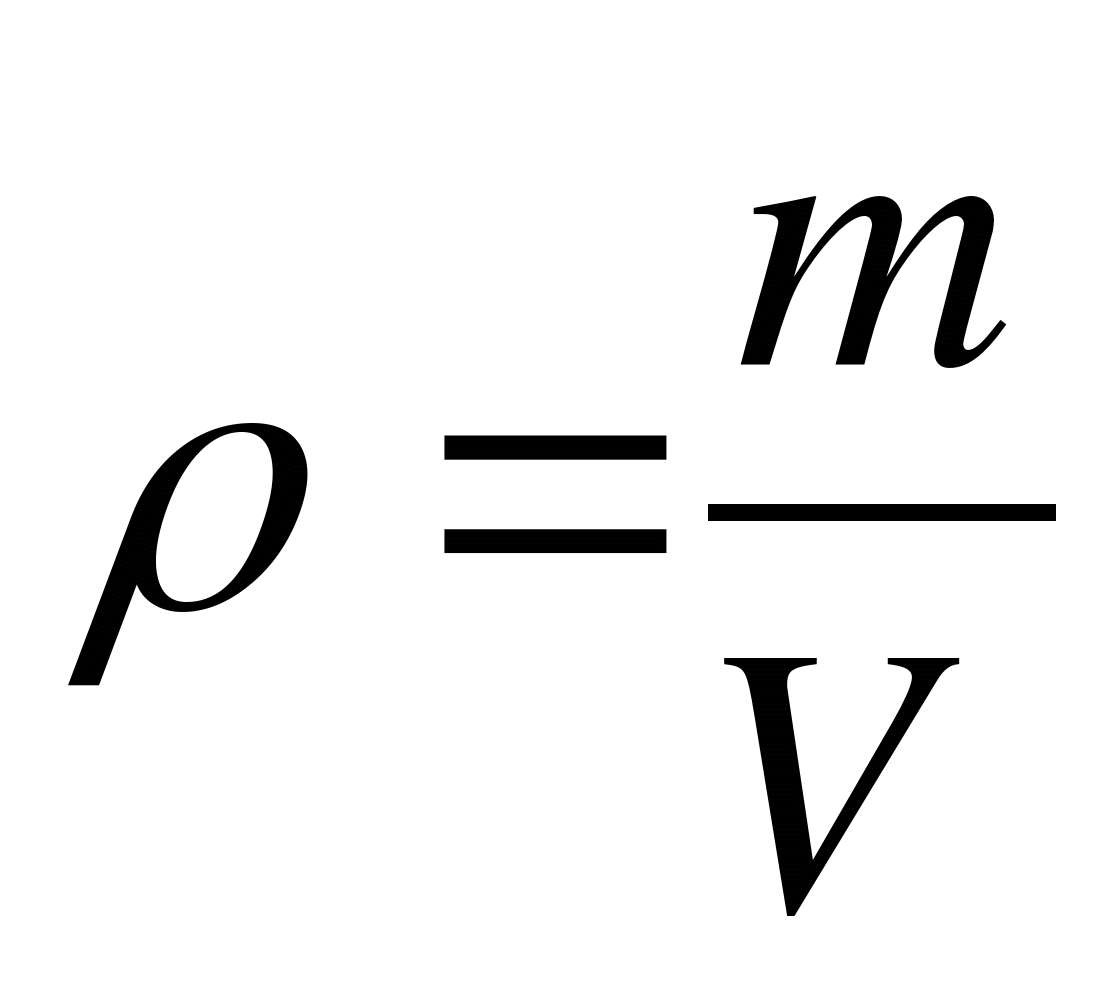 . Б.
. Б. 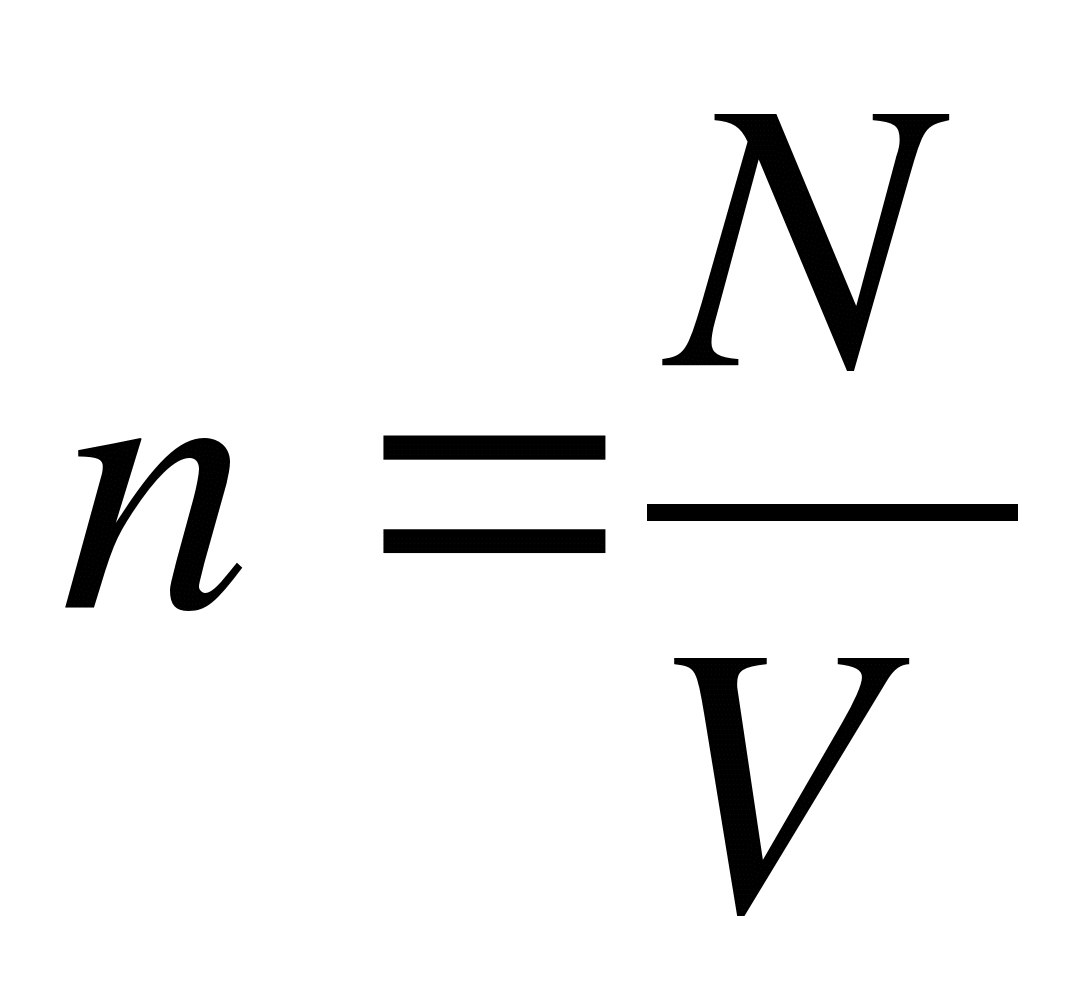 . В.
. В. 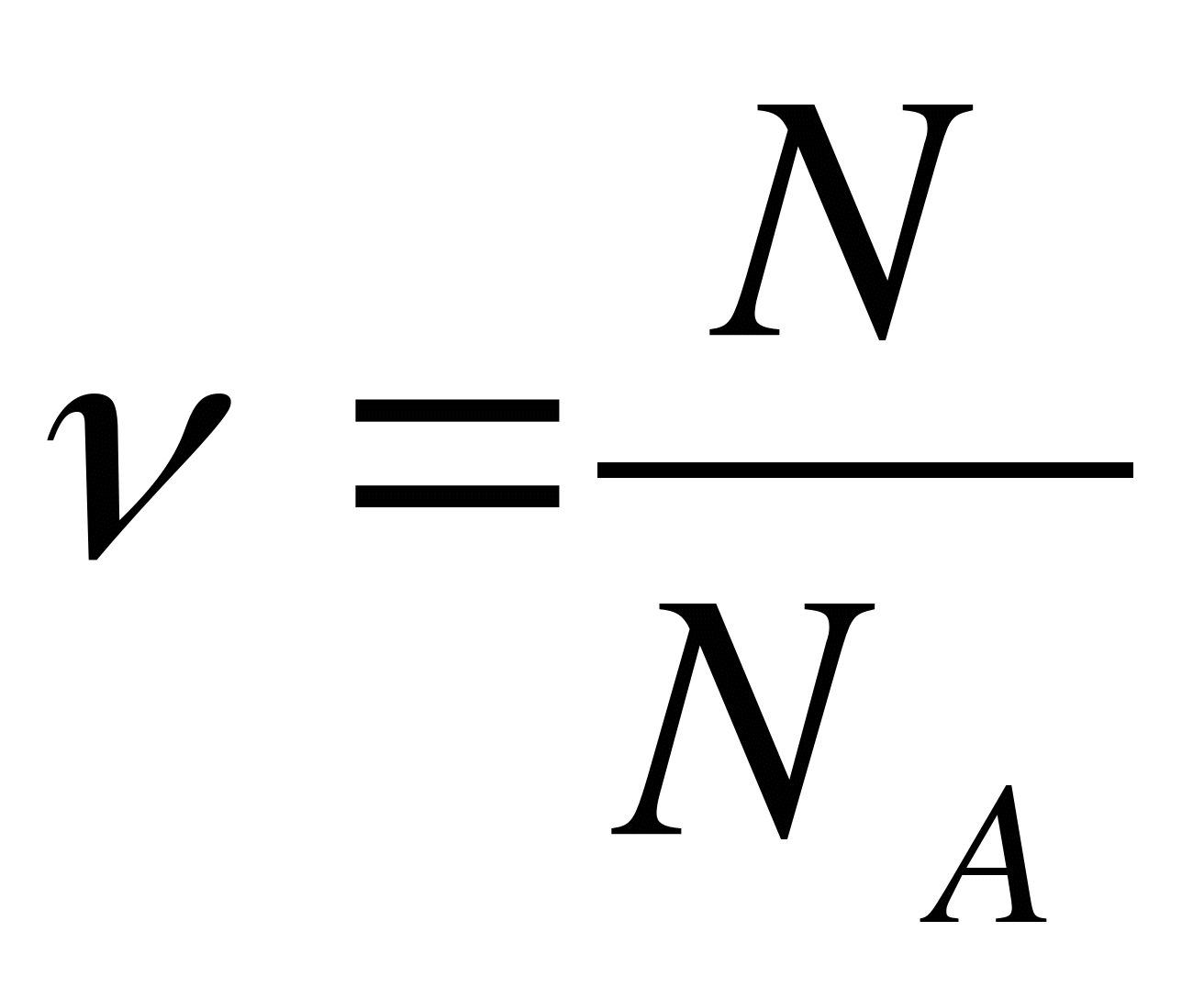 . Г.
. Г. 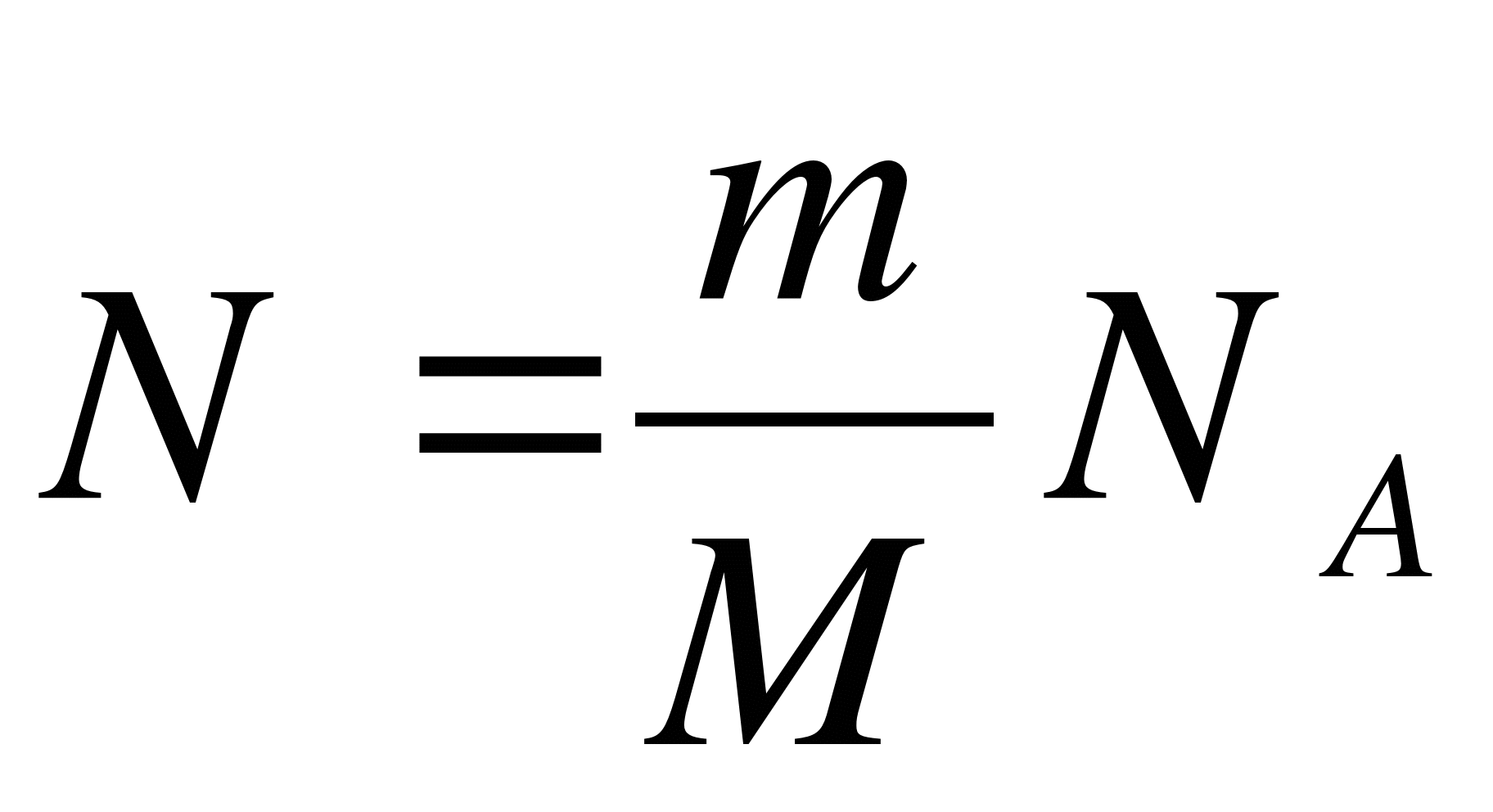 . Д.
. Д. 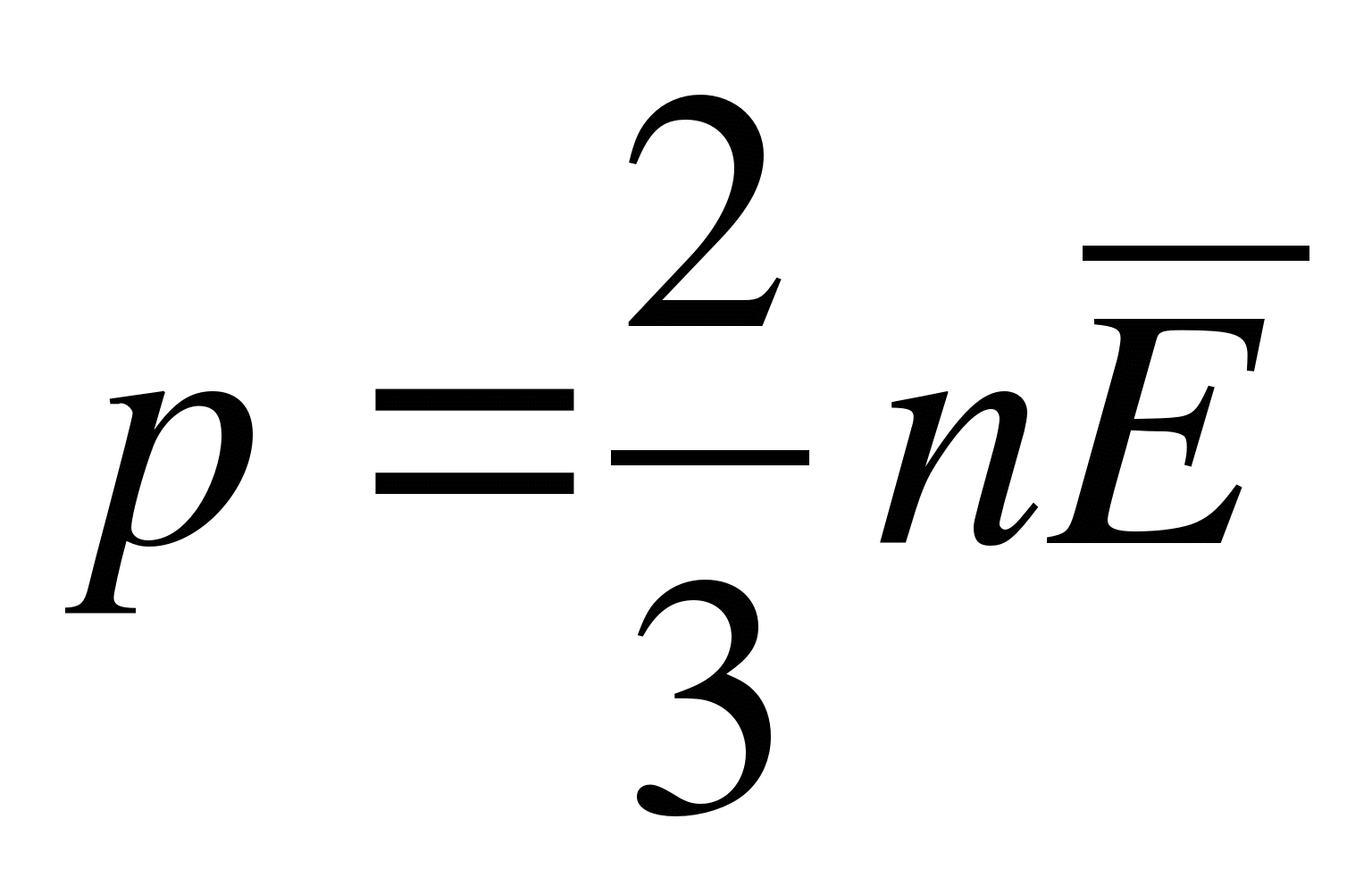 .
.
35. Чем обусловлено броуновское движение ?
А) Столкновением молекул жидкости (или газа) друг с другом;
Б) Столкновением частиц, взвешенных в жидкости (или газе)
В) Столкновением молекул жидкости (или газа) с частицами, взвешенными в ней (нём)
Г) Ни одной из указанных причин.
Какое давление на стенки сосуда производит кислород, если V =400m/c, n =2,7*1019m-3
37. Какое количество вещества содержится в медной отливке массой 128г?
Тест по физике (10 класс) на тему: Основные положения молекулярно-кинетической теории. Тест для 10 класса
Слайд 1
Основные положения молекулярно-кинетической теории 10 класс. Тест.
Слайд 2
1. Выберете верные утверждения __Классическая механика Ньютона не может объяснить тепловые явления __ Тепловое движение происходит внутри любого движущегося тела __ Молекулярно-кинетическая теория стремится объяснить тепловые процессы __ Изменение агрегатных состояний вещества относится к тепловым явлениям
Слайд 3
2. Выберете тела, являющиеся макроскопическими 1) Бабочка 2) Песчинка 3) Электрон 4) Мотоцикл
Слайд 4
3. Какие из ниже перечисленных параметров являются макроскопическими? 1) Скорость 2) Давление 3) Температура 4) Кинетическая энергия
Слайд 5
4. В каких телах наблюдается беспорядочное движение молекул? 1) В твердых 2) В жидких 3) В газообразных 4) В твердых, жидких и газообразных
Слайд 6
5. Между частицами внутри тел существуют… 1) Только силы притяжения 2) Только силы отталкивания 3) Силы притяжения и силы отталкивания
Слайд 7
6. В каком состоянии при нормальных условиях расстояния между молекулами больше всего? 1) Лед 2) Вода 3) Водяной пар 4) Независимо от состояния, расстояние между молекулами сохраняется, т.к. речь идет об одном и том же веществе
Слайд 8
7. Укажите приблизительные размеры (диаметр) неорганических молекул 1) Порядка 10 -10 м 2) Порядка 10 -6 м 3) Порядка 10 -12 м 4) Порядка 10 -24 м
Слайд 9
8. Что является главным доказательством молекулярно-кинетической теории? 1) Размеры молекул 2) Масса молекул 3) Броуновское движение 4) Существование субатомных частиц
Слайд 10
9. Выберете верные утверждения __Молекулы твердых тел неподвижны __ Молекулы жидкости могут перемещаться внутри этой жидкости __ Молекулы газа не имеют никакого порядка __ Молекулы газа колеблются около положения равновесия
Слайд 11
10. Что влияет на свойства тела? 1) Из каких частиц тело состоит 2) Количество частиц, из которых состоит тело 3) Порядок расположения частиц в теле 4) Масса частиц, из которых состоит тело
Слайд 12
Ответы: 1) Да Нет Да Да 2) 1 2 4 3) 2 3 4) 4 5 ) 3 6) 3 7 ) 1 8) 3 9) Нет Да Да Нет 10) 1 3
Тест по физике (10 класс) на тему: Зачётная работа по разделу физики «Молекулярно — кинетическая теория»
ВАРИАНТ 1.
I. Дописать определения:
- Большое тело, состоящее из огромного числа молекул или атомов – это…(1б)
- Количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг называется …..(1б)
- Беспорядочное (хаотическое) движение взвешенных в жидкости или газе частиц называется…..(1б)
- Величины, характеризующие состояние макроскопических тел (идеального газа) без учёта молекулярного строения – это …..(1б)
II. Дать определение:
- Основные положения МКТ. (2б)
- Давление газа с точки зрения МКТ. (2б)
- Температура (в том числе через связь со средней кинетической энергией) (3б)
III. По таблице найди соответствие для величин первого столбика и запиши их, например 1-3-5-2: (за каждое правильно составленное соответствие 2б )
1 | 2 | 3 | 4 |
Величина | Обозначение | Единицы измерения | Формула для расчёта |
1.Количество вещества | 1. | 1. | 1. |
2.Число молекул | 2. | 2. | 2.
|
3.Масса молекулы | 3. | 3. | 3. |
4. | 4. | 4. | |
5. | 5. | 5. |
IV. Записать формулы
- Основное уравнение МКТ (за каждое уравнение 1б).
- Закон Авогадро(2б).
ВАРИАНТ 2.
I. Дописать определения:
- Беспорядочное движение частиц (молекул или атомов), из которых состоит тело называется….(1б)
- Масса вещества в количестве одного моля – это …..(1б)
- Взаимное проникновение молекул одного вещества между молекулами другого вещества называется…..(1б)
- Равнодействующая сил притяжение и отталкивания между молекулами или атомами называется ….(1б)
II. Дать определение:
- Модель идеального газа. (2б)
- Тепловое равновесие. (2б)
- Абсолютная шкала температур: определение абсолютного нуля, цена деления, связь со шкалой Цельсия. (3б)
III. По таблице найди соответствие для величин первого столбика и запиши их, например 1-3-5-2: (за каждое правильно составленное соответствие 3б )
1 | 2 | 3 | 4 |
Величина | Обозначение | Единицы измерения | Формула для расчёта |
1.Количество вещества | 1. | 1. | 1. |
2.Число молекул | 2. | 2. | 2. |
3.Масса любого вещества | 3. | 3. | 3. |
4. | 4. | 4. | |
5. | 5. | 5. |
IV. Записать формулы:
- Формула связи средней кинетической энергии и абсолютной температуры (2б).
- Расчёта средней квадратической скорости молекул (3б).
Тесты для контроля знаний по теме: «Молекулярная физика»
Основные положения МКТ. (К. №1)
1. Какие наблюдения показывают, что каждое тело
состоит из мельчайших частиц?
2. Какие факты доказывают, что между молекулами
существуют промежутки?
3. Какие факты доказывают, что между молекулами
твердых тел существуют силы притяжения?
4. Какие факты доказывают, что между молекулами
жидкости существуют силы притяжения?
5. Какие факты доказывают, что между молекулами
газов существуют силы притяжения?
6. Какие факты доказывают, что между молекулами
веществ есть силы отталкивания?
7. Какова природа сил притяжения и отталкивания
между молекулами?
8. Что такое диффузия и на что она указывает?
9. Что называется броуновское движение?
10. Как зависит скорость диффузии от агрегатного
состояния вещества?
11. Как зависит диффузия от температуры?
Код | Ответ | Код | Ответ |
А | взаимное проникновение молекул одного
вещества между молекулами другого вещества. | И | При сближении двух свинцовых цилиндров
с зачищенными поверхностями они «слипаются». |
Б | электромагнитная |
| гравитационная |
В | При сближении двух свинцовых цилиндров
с зачищенными поверхностями они «слипаются», при растяжении и разрушении тела необходимо приложить силу | К | при резком расширении сжатого газа
происходит охлаждение, т.к. часть энергии идет на преодоление сил притяжения |
Г | при сжатии тел в любом агрегатном
состоянии возникает сопротивление. | Л | беспорядочное движение взвешенных
частиц в жидкости или газе. |
Д | при увеличении температуры скорость
диффузии уменьшается. | М | при увеличении температуры скорость
диффузии увеличивается |
Е | распространение запаха, растворение
веществ, испарение, размельчение твердого тела, деление вещества и т.д. | Н | в твердых телах проходит быстро,
медленнее в жидкостях, очень медленно в газах. |
Ж | в твердых телах проходит медленно,
быстрее в жидкостях, очень быстро в газах | О | необходимо приложить некоторую силу,
чтобы оторвать стеклянную пластинку от поверхности воды. |
З | взаимное проникновение молекул одного
вещества между молекулами другого вещества. Это означает, что частицы находятся в непрерывном движении, между которыми есть промежутки | П | твердые, жидкие и газообразные тела при
увеличении внешнего давления уменьшаются в объеме. При изменении температуры также меняется объем указанных тел. |
Р | твердые, жидкие и газообразные
тела при увеличении внешнего давления уменьшаются в объеме. При изменении температуры также меняется объем указанных тел, уменьшение объема при смешении воды со спиртом, просачивание масла через сталь. | ||
Количество вещества. Масса молекул. (К.
№2)
1. Что называется относительной молекулярной
массой?
2. Что называется количеством вещества?
3. Укажите единицу измерения количества
вещества в СИ?
4. Физический смысл единицы количества вещества
в СИ?
5. Укажите формулу, по которой определяется
количество вещества?
6. Укажите условное обозначение количества
вещества?
7. Что называется числом Авогадро?
8. Укажите численное значение числа Авогадро.
9. Что называется молярной массой?
10. Укажите единицу молярной массы.
11. Укажите обозначение молярной массы.
12. Укажите формулу, по которой определяется
молярная масса.
13. Как можно определять массу любого количества
вещества?
КОД | ОТВЕТ | КОД | ОТВЕТ |
А | отношение массы вещества к количеству
вещества. | М | отношение массы молекулы данного
вещества к 1/12 массы атома углерода. |
Б | 6* Ю-32 | Н | масса одной моли вещества. |
В | количество вещества, в котором
содержится столько же молекул (атомов), сколько атомов содержится в углероде массой 0,012 кг. | О | отношение числа молекул в данном теле к
числу молекул в одном моле вещества. |
Г | количество молекул (атомов) в 1 моле
любого вещества. | П | |
Д | m0NA | Р | 6*1023 |
Е | n | С | моль |
Ж | Т | ||
З | У | ||
И | моль/кг | Ф | кг/моль |
К | Х | ||
Л | Ц |
1. Что называется тепловым движением?
2. Какова особенность теплового движения
молекул в твердом теле?
3. Какова особенность теплового движения
молекул в жидких телах?
4. Какова особенность теплового движения в
газах?
5. Что называется внутренней энергией тела?
6. Что характеризует температура?
7. От чего зависит энергия молекул?
8. В каких телах потенциальная энергия молекул
больше: твердых, жидких или газообразных?
9. Как изменяется скорость теплового движения
при увеличении температуры?
10. Какая энергия молекул (кинетическая или
потенциальная) в основном изменяется при
изменении температуры?
КОД | ОТВЕТ | КОД | ОТВЕТ |
А | потенциальная энергия молекул газа в
несколько раз больше, чем потенциальная энергия молекул жидкости или твердого тела. | Л | потенциальная энергия молекул твердого
тела в несколько раз больше, чем потенциальная энергия молекул жидкости или газа. |
Б | молекулы совершают колебательное и
поступательное движение. | М | молекулы совершают в основном
колебательное движение. |
В | молекулы движутся прямолинейно от
столкновения до столкновения друг с другом. | Н | от взаимного положения молекул, от
взаимодействия молекул и от температуры тела. |
Г | потенциальная и кинетическая энергия
молекул. | О | от скорости беспорядочного движения
молекул. |
Д | потенциальная энергия. | П | от рода вещества. |
Е | кинетическая энергия. | Р | беспорядочное движение молекул. |
Ж | состояние теплового равновесия системы
тел. | С | от температуры. |
З | от расстояния между молекулами. | Т | поступательное движение молекул. |
И | увеличивается. | У | уменьшается. |
К | степень нагретости тела. |
|
1. Что такое температура?
2. Какую температуру принимают за абсолютный
нуль температуры?
3. Можно ли экспериментально получить
абсолютный нуль?
4. Как измеряют температуру:
непосредственно или косвенным методом?
5. Какое явление используется для
измерения температуры в жидкостных термометрах?
6. Какой термометр дает правильные
показания?
7. Прекращается ли движение молекул при
абсолютном нуле?
8. Укажите соотношение между
температурами по шкале Цельсия и Кельвина.
9. Самая низкая температура,
достигнутая экспериментально?
10. Чему равна температура по шкале
Цельсия соответствующая абсолютному нулю?
11. Укажите единицу термодинамической
температуры в СИ.
КОД | ОТВЕТ | КОД | ОТВЕТ |
А | Измерить температуру можно только
косвенным методом: расширение (сжатие) газов, (жидкости) при изменении температуры. | М | непосредственно можно измерить
температуру, если измерительный прибор непосредственно прикасается с нагретым телом. |
Б | предельная температура, при которой
давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю. | Н | величина, характеризующая среднюю
кинетическую энергию движения молекул идеального газа. |
В | изменение давления при изменении
температуры. | О | изменение объема. |
Г | Нет. Ни какой опыт не позволил охладить
до абсолютного нуля. | П | Можно охладить до абсолютного нуля. |
Д | Т=273+t | Р | t=273+Т |
Е | -273,15° | С | +273,15° |
З | температура таяния льда. | Т | водородный термометр. |
И | величина, характеризующая кинетическую
энергию поступательного движения молекул. |
Тест по физике на тему»Основы молекулярно-кинетической теории» (10 класс)
Тема: «Основы молекулярно-кинетической теории»
ВАРИАНТ 1
1. Молярной массой вещества называют
1) массу 12 г углерода
2) массу одной молекулы
3) массу одного моля вещества
4) массу всех молекул данного вещества
2. Температура по абсолютной шкале составляет 20К. Это соответствует температуре по шкале Цельсия
1) 2530С 3) 2930С
2) -2530С 4) -2930 С
3. Температура жидкости понизилась на 70С. По абсолютной шкале температур это изменение составило
1) 0 К 3) 266 К
2) 7 К 4) 280 К
4. Молекулы азота движутся со средней квадратичной скоростью 700 м/с. При какой температуре это возможно?
1) 1000С 3) 5500С
2) 2770С 4) 8230С
5. Абсолютную температуру идеального газа понизили в 2,5 раза. При этом средняя кинетическая энергия теплового движения молекул
1) увеличится в 2,5 раза
2) уменьшится в 2,5 раза
3) уменьшится в 6,25 раза
4) не изменится
6. В сосуде находится 16 кг кислорода при температуре 270С и давлении 105 Па. Чему равен объём сосуда?
1) 1,1 м3 3) 12,5 м3
2) 1,2.10-2 м3 4) 12,5 .10-2 м3
7. Один моль идеального газа занимает объём V1, имеет температуру Т1 и давление р1. Каков объём данного газа, взятого в количестве 4 моль, при той же температуре и давлении 2р1 ?
1) V1 3) 4V1
2) 2V1 4) 8V1
.
8. Идеальный газ, постоянной массы изохорно нагревают. При этом его температура изменяется на 1200С, а давление возрастает в 1,8 раза. Определите начальную температуру газа по шкале Цельсия.
1) -1230С 3) 1500С
2) 00С 4) 4230С
9. Выберите из четырех процессов изменения состояния идеального газа изотермическое расширение
1) 1
2) 2
3) 3
4) 4
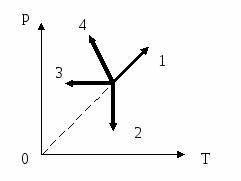
10. В какой точке данного процесса температура идеального газа имеет наибольшее значение, если количество вещества остаётся постоянным?
1) 1
2) 2
3) 3
4) во всех точках температура одинакова
Тема: «Основы молекулярно-кинетической теории»
ВАРИАНТ 2
1. Относительной молекулярной массой вещества называют
1) массу одной молекулы
2) массу одного моля вещества
3) массу всех молекул данного вещества
4) отношение массы молекулы данного вещества к 1/12 массы атома углерода
2. Температура по шкале Цельсия составляет 200С. Это соответствует температуре по абсолютной шкале
1) 253 К 3) 293 К
2) -253 К 4) -293 К
3. Температура газа повысилась на 27 К. По шкале Цельсия это изменение составило
1) 00С 3) 2460С
2) 270С 4) 3000С
4. Молекулы кислорода движутся со средней квадратичной скоростью 600 м/с. При какой температуре это возможно?
1) 1000С 3) 4620С
2) 1890С 4) 7350С
5. Абсолютную температуру идеального газа повысили в 6,25 раза. При этом средняя квадратичная скорость движения молекул
1) уменьшится в 2,5 раза
2) увеличится в 2,5 раза
3) увеличится в 6,25 раза
4) не изменится
6. В сосуде объёмом 15 м3 находится 14 кг азота. Давление внутри сосуда 2.105 Па. Определите температуру газа?
1)2730С 3) 361 К
2) 7220С 4) 722 К
7. Два моля идеального газа занимает объём V1, имеет температуру Т1 и давление р1. Каков объём данного газа, взятого в количестве 4 моль, при том же давлении и температуре 2Т1 ?
1) V1 3) 4V1
2) 2V1 4) 8V1
.
8. Идеальный газ, постоянной массы изобарно нагревают. При этом его температура увеличивается в 2 раза, а объём возрастает на 300 л. Определите первоначальный объём газа (в дм3).
1) 0 дм3 3) 300 дм3
2) 150 дм3 4) 600 дм3
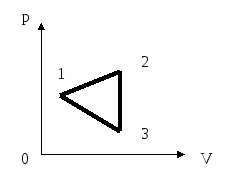
9. Выберите из четырех процессов изменения состояния идеального газа изохорное нагревание
1) 1
2) 2
3) 3
4) 4
10. В какой точке данного процесса температура идеального газа имеет наименьшее значение, если количество вещества остаётся постоянным?
1) 1
2) 2
3) 3
4) во всех точках температура одинакова
Тест на тему: «МКТ». 10 класс
Тест на тему:«Молекулярно-кинетическая теория» 10 класс.
1. Связывает температуру в энергетических единицах с температурой Т = [K].
А) Коэффициент пропорциональности.
Б) Число Авагадро.
В) Универсальная Газовая постоянная.
Г) Термостат.
Д) Постоянная Больцмана.
2. Какими эффектами в газе можно пренебречь для того, чтобы газ считался идеальным?
А) Взаимодействием молекул при столкновении.
Б) Внутренней энергией газа.
В) Массами молекул.
Г) Взаимодействием молекул на расстоянии
Д) Столкновением молекул.
3. Выберите правильные утверждения «Абсолютная термодинамическая температура:
1. Не зависит от термометрического вещества.
2. Устанавливается вторым началом термодинамики.
3. Существует в идеальных системах»:
А) 3. Г) 2.
Б) 1,2. Д) 1,3.
В) 1.
4. Как изменилось давление идеального газа при переходе из состояния 1 в состояние 2 (рис.)?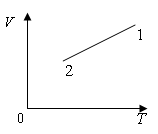
А) Могло увеличиться или уменьшится.
Б) Осталось неизменным.
В) Увеличилось.
Г) Уменьшилось.
Д) Процесс невозможен.
5. Какие два процесса изменения состояния газа представлены на графиках?
А) 1-изотермический, 2- изобарный.
Б) 1 и 2-изотермические.
В) 1- изобарный, 2-изотермический.
Г) 1-изотермический, 2-изохорный.
Д) 1-изохорный, 2-изотермический.
6. Сколько молекул содержится в газе объемом
3 м3 при давлении 100 кПа и температуре 27˚С:
А) 5·1025 Г) 1·1025
Б) 3·1025 Д) 72·1025
В)7,2·10
7. Основное уравнение молекулярно-кинетической теории идеального газа:
А) P =nkT
Б) PV = const.
В) .
Г) PV = 2/3 n0 RT.
Д) PV = RT.
8. Давление идеального газа зависит непосредственно от:
А) Кинетической энергии молекул.
Б) Силы притяжения молекул.
В) Средней длины свободного пробега.
Г) Числа столкновений молекул.
Д) Размеров молекул.
9. Какая из приведенных ниже формул является основным уравнением молекулярно-кинетической теории идеального газа:
А)  Г)
Г) 
Б) P = n (Еок). Д) 
В) 
10. Как изменяется скорость испарения жидкости при повышении температуры?
А) Уменьшается.
Б) Увеличивается.
В) Может увеличиваться, а может уменьшаться.
Г) Остается неизменной.
Д) Вначале увеличивается, а затем уменьшается.
11. Тела состоящие из большого числа молекул называют…
А) Физической величиной.
Б) Кристаллической решеткой.
В) Броуновским движением.
Г) Макроскопическими телами.
Д) Твердыми телами.
12. Какой температуре по шкале Цельсия соответствует температура Т=152 К?
А) 160 С. Г) 320 С.
Б) 60 С. Д) -121°С.
В)-60 С.
13. Основными макроскопическими параметрами являются…
А) Т, P, m.
Б) NA, V, Mr.
В) t, P, V.
Г) t, , R.
14. В чем различие между уравнениями Менделеева и уравнениями Клапейрона? Ответ дать в виде уравнений. (2 балла)
15. Графически изобразите III изопроцесса. (3 балла)
Кинетическая молекулярная теория
Кинетическая молекулярная теория
Кинетическая молекулярная теория
Постулаты кинетической молекулярной теории
Экспериментальные наблюдения за поведением газов, обсуждаемые до сих пор, могут быть
объясняется с помощью простой теоретической модели, известной как кинетическая молекулярная теория .
Эта теория основана на следующих постулатах или предположениях.
- Газы состоят из большого количества частиц, которые ведут себя как твердые сферические частицы.
объекты в состоянии постоянного случайного движения. - Эти частицы движутся по прямой линии, пока не столкнутся с другой частицей или
стенки контейнера. - Эти частицы намного меньше, чем расстояние между частицами. Большая часть объема
газа, следовательно, пустое пространство. - Нет силы притяжения между частицами газа или между частицами и
стенки контейнера. - Столкновения между частицами газа или столкновения со стенками контейнера
идеально эластичный. Никакая энергия частицы газа не теряется при столкновении с
другая частица или со стенками емкости. - Средняя кинетическая энергия скопления частиц газа зависит от температуры.
газа и ничего больше.
Предположения, лежащие в основе кинетической молекулярной теории, можно проиллюстрировать с помощью
устройство, показанное на рисунке ниже, которое состоит из стеклянной пластины, окруженной стенками
установлен поверх трех вибрационных двигателей.Горстка стальных шарикоподшипников размещена на
верхняя часть стеклянной пластины для представления частиц газа.
При включении двигателей стеклянная пластина вибрирует, что заставляет шариковые подшипники
двигаться постоянным, случайным образом (постулат 1). Каждый шар движется по прямой, пока
он сталкивается с другим шаром или со стенками контейнера (постулат 2). Хотя
столкновения часты, среднее расстояние между шарикоподшипниками намного больше
чем диаметр шариков (постулат 3).Между ними нет силы притяжения
отдельные шарикоподшипники или между шарикоподшипниками и стенками контейнера
(постулат 4).
Столкновения, которые происходят в этом аппарате, сильно отличаются от тех, которые происходят
когда на пол падает резиновый мяч. Столкновения резинового мяча с
пол неэластичный , как показано на рисунке ниже. Часть энергии
мяч теряется каждый раз, когда падает на пол, пока в конце концов не остановится.В этом
Аппарат, наезды отлично , упругие . У мячей столько же
энергия после столкновения по-прежнему (постулат 5).
Любой движущийся объект имеет кинетическую энергию , которая определяется как половина
произведения его массы на квадрат скорости.
KE = 1 / 2 мв 2
В любой момент некоторые шарикоподшипники этого устройства движутся быстрее других,
но система может быть описана средней кинетической энергией .Когда мы увеличиваем
«температура» системы за счет увеличения напряжения на двигателях, находим
что средняя кинетическая энергия шариковых подшипников увеличивается (постулат 6).
Как кинетическая молекула
Теория объясняет законы о газе
Кинетическая молекулярная теория может быть использована для объяснения каждого из экспериментальных
определены газовые законы.
Связь между P и n
Давление газа возникает в результате столкновения частиц газа со стенками.
контейнера.Каждый раз, когда частица газа ударяется о стену, она оказывает на нее силу.
Увеличение количества частиц газа в емкости увеличивает частоту
столкновения со стенками и, следовательно, давление газа.
Закон Амонтона ( PT )
Последний постулат кинетической молекулярной теории утверждает, что средний кинетический
энергия частицы газа зависит только от температуры газа. Таким образом, средний
кинетическая энергия частиц газа увеличивается по мере того, как газ становится теплее.Потому что масса
этих частиц постоянна, их кинетическая энергия может увеличиваться только в том случае, если средняя
скорость частиц увеличивается. Чем быстрее эти частицы движутся при ударе
стены, тем большую силу они оказывают на стену. Поскольку сила на столкновение
становится больше при повышении температуры, давление газа должно увеличиваться как
хорошо.
Закон Бойля ( P = 1/ v )
Газы можно сжимать, потому что большая часть газа — это пустое пространство.Если мы
сжать газ без изменения его температуры, средняя кинетическая энергия газа
частицы остаются прежними. Нет изменения скорости, с которой движутся частицы,
но емкость меньше. Таким образом, частицы перемещаются от одного конца контейнера к
другой в более короткий период времени. Это означает, что они чаще ударяются о стены. любой
увеличение частоты столкновений со стенками должно приводить к увеличению
давление газа. Таким образом, давление газа увеличивается по мере увеличения объема газа.
становится меньше.
Закон Чарльза ( V T )
Средняя кинетическая энергия частиц в газе пропорциональна температуре
газа. Поскольку масса этих частиц постоянна, частицы должны двигаться
быстрее по мере того, как газ становится теплее. Если они будут двигаться быстрее, частицы будут проявлять больше
силы на контейнер каждый раз, когда они ударяются о стенки, что приводит к увеличению
давление газа.Если стенки контейнера гибкие, он будет расширяться до тех пор, пока
давление газа еще раз уравновешивает давление атмосферы. Объем
газа поэтому становится больше по мере увеличения температуры газа.
Гипотеза Авогадро ( V N )
С увеличением количества частиц газа частота столкновений со стенками
емкость должна увеличиваться. Это, в свою очередь, приводит к увеличению давления
газ.Гибкие контейнеры, такие как воздушный шар, будут расширяться до тех пор, пока давление газа не снизится.
внутри воздушный шар снова уравновешивает давление газа снаружи. Таким образом, объем
газа пропорционально количеству частиц газа.
Закон парциальных давлений Дальтона ( P t = P 1
+ P 2 + P 3 + …)
Представьте, что было бы, если бы к молекулярной динамике добавить шесть шарикоподшипников разного размера.
симулятор.Общее давление увеличилось бы, потому что было бы больше
столкновения со стенками контейнера. Но давление из-за столкновений между
оригинальные шарикоподшипники и стенки контейнера остались прежними. Там есть
в контейнере столько пустого места, что каждый шарикоподшипник ударяется о стенки
контейнер так часто в смеси, как если бы был только один вид шарикоподшипника
на стеклянной пластине. Общее количество столкновений со стенкой в этой смеси равно
поэтому равняется сумме столкновений, которые произошли бы, когда мяч каждого размера
подшипник присутствует сам по себе.Другими словами, полное давление смеси газов равно
равно сумме парциальных давлений отдельных газов.
Законы диффузии и вытекания Грэма
Некоторые физические свойства газов зависят от его свойств. Один из
эти физические свойства можно увидеть при изучении движения газов.
В 1829 году Томас Грэм использовал прибор, подобный показанному на
рисунок ниже для изучения диффузии
газов скорость, с которой два
смесь газов.Этот аппарат состоит из стеклянной трубки, запечатанной с одного конца гипсом,
отверстия достаточно большие, чтобы газ мог входить или выходить из трубки. Когда трубка заполнена
H 2 газ, уровень воды в трубке медленно поднимается, т.к. H 2
молекулы внутри трубки уходят через отверстия в штукатурке быстрее, чем
молекулы воздуха могут попасть в трубку. Изучая скорость, с которой уровень воды в этом
прибор изменился, Грэм смог получить данные о скорости, с которой различные газы
смешанный с воздухом.
Грэм обнаружил, что скорость диффузии газов обратно пропорциональна
квадратный корень из их плотностей.
Это соотношение в конечном итоге стало известно как закон диффузии Грэма .
Чтобы понять важность этого открытия, мы должны помнить, что равные объемы
разных газов содержат одинаковое количество частиц.В результате количество родинок
газа на литр при данной температуре и давлении является постоянным, а это означает, что
плотность газа прямо пропорциональна его молекулярной массе. Закон Грэма
диффузию поэтому также можно записать следующим образом.
Подобные результаты были получены, когда Грэм изучал скорость излияний
газа, которая представляет собой скорость, с которой газ выходит через точечное отверстие в вакуум. В
скорость истечения газа также обратно пропорциональна квадратному корню из
плотность или молекулярный вес газа.
Закон излияния Грэма может быть продемонстрирован с помощью аппарата в
рисунок ниже. Откачивают толстостенную фильтровальную колбу с помощью вакуумного насоса. Шприц
заполнен 25 мл газа и время, необходимое для выхода газа через шприц
игла в откачанную колбу фильтра измеряется секундомером.
Как мы можем видеть, когда данные, полученные в этом эксперименте, представлены на рисунке ниже,
время , необходимое для выхода 25-миллилитровых проб различных газов в вакуум, составляет
пропорциональна корню квадратному из молекулярной массы газа.Оценка на
который истекает, поэтому обратно пропорционален квадратному корню из
молекулярный вес. Наблюдения Грэма о скорости, с которой газы диффундируют (смешиваются) или
эффузия (утечка через точечное отверстие) предполагает, что относительно легкие частицы газа, такие как H 2
молекулы или атомы He движутся быстрее, чем частицы относительно тяжелого газа, такие как CO 2
или SO 2 молекул.
Кинетическая молекулярная теория и законы Грэма
Кинетическая молекулярная теория может быть использована для объяснения результатов, полученных Грэхемом, когда он
изучал диффузию и истечение газов.Ключ к этому объяснению — последний
постулат кинетической теории, который предполагает, что температура системы
пропорциональна средней кинетической энергии его частиц и ничего больше. В других
словами, температура системы увеличивается тогда и только тогда, когда происходит увеличение
средняя кинетическая энергия его частиц.
Два газа, такие как H 2 и O 2 , с одинаковой температурой, поэтому
должна иметь одинаковую среднюю кинетическую энергию.Это можно представить следующим образом
уравнение.
Это уравнение можно упростить, умножив обе части на два.
Затем его можно изменить, чтобы получить следующее.
Извлечение квадратного корня из обеих частей этого уравнения дает связь между
отношение скоростей движения двух газов и квадратный корень из отношения
их молекулярный вес.
Это уравнение представляет собой модифицированную форму закона Грэма. Это говорит о том, что скорость (или
скорость), с которой движутся молекулы газа, обратно пропорциональна квадратному корню из их
молекулярные массы.
.
Кинетическая молекулярная теория: термины и формулы
условия
Постоянная Больцмана
Константа k , входящая в уравнение для средней скорости. к = 1,38 × 10 -23 Дж / К
Распространение
Распространение — это распространение одного вещества через другое.
Выпот
Вытекание — это скорость, с которой газ проходит через небольшое отверстие в вакуум.
Кинетическая энергия
E k = 1/2 mv 2
Кинетическая молекулярная теория
Теория, моделирующая взаимодействие между отдельными молекулами газа. Увидеть
резюме
Больше подробностей.
Распределение скорости Максвелла-Больцмана
Распределение, достигаемое, когда скорость молекул сравнивается с количеством молекул, разделяющих эту скорость.
Длина свободного пробега
Среднее расстояние, которое проходит молекула до столкновения с другой молекулой; учитывая огромный
количество столкновений в газе, длина свободного пробега намного меньше, чем в любой типичной комнате
или контейнер. Уравнение для длины свободного пробега:
λ =  |
м п
Наиболее вероятная скорость, с которой движется большинство молекул в газе.Формула наиболее вероятного
скорость:
v p =  = =  |
Среднеквадратичная скорость
Уравнение для измерения типичной скорости молекул в газе.
Формулы
| Средняя скорость  | |
| Кинетическая энергия | E k = 1/2 mv 2 |
| Длина свободного пробега |
|
| Формула для наиболее вероятной скорости |
|
| Формула для среднеквадратичной скорости | |
.
10.7 Кинетическая молекулярная теория Кинетическая молекулярная теория. Кинетическая молекулярная теория. Кинетическая молекулярная теория. Кинетическая молекулярная теория
Транскрипция
1 неделя лекций — предварительная 0.7 Кинетико-молекулярная теория 40 Применение к законам газа 0.8 Молекулярный истечение и диффузия 43 Закон Грэма эффузионной диффузии и средней длины свободного пробега 0.9 Реальные газы: отклонения 47 Глава об уравнении Ван-дер-Ваальса Межмолекулярные силы, жидкости и твердые тела. Молекулярное сравнение жидкостей и твердых тел 444. Межмолекулярные силы 445 Ион-дипольные силы Диполь-дипольные силы Лондонские дисперсионные силы Водородная связь Сравнение межмолекулярных сил.3 Некоторые свойства жидкостей 453 Вязкость Поверхностное натяжение.4 Фазовые изменения 455 Изменения энергии, сопровождающие фазовые изменения Кривые нагрева Критическая температура и давление.5 Давление пара 459 Объяснение давления пара на молекулярном уровне Летучесть, давление пара и температура Давление пара и точка кипения 0.7 Разработана теория для объяснения поведения газа. Теория, основанная на свойствах на молекулярном уровне. Кинетическая молекулярная теория дает нам модель для понимания давления и температуры на молекулярном уровне. Давление газа определяется количеством ударов в единицу времени о стенки контейнера. 0.7 В любой пробе газа существует разброс индивидуальных энергий молекул газа. С повышением температуры увеличивается средняя кинетическая энергия молекул газа. Допущения: Газы состоят из большого количества молекул, находящихся в постоянном случайном движении.Объем отдельных молекул незначителен по сравнению с объемом контейнера. Межмолекулярные силы (силы притяжения или отталкивания между молекулами газа) незначительны. Энергия может передаваться между молекулами, но общая кинетическая энергия постоянна при постоянной температуре. Средняя кинетическая энергия молекул пропорциональна температуре. Величина давления определяется частотой и силой ударов молекул. Молекулы газа обладают средней кинетической энергией. Каждая молекула может иметь разную энергию.По мере увеличения кинетической энергии скорость молекул газа увеличивается. Среднеквадратичная скорость u — это скорость молекулы газа, имеющей среднюю кинетическую энергию. Средняя кинетическая энергия ε связана со среднеквадратичной скоростью: ε = mu

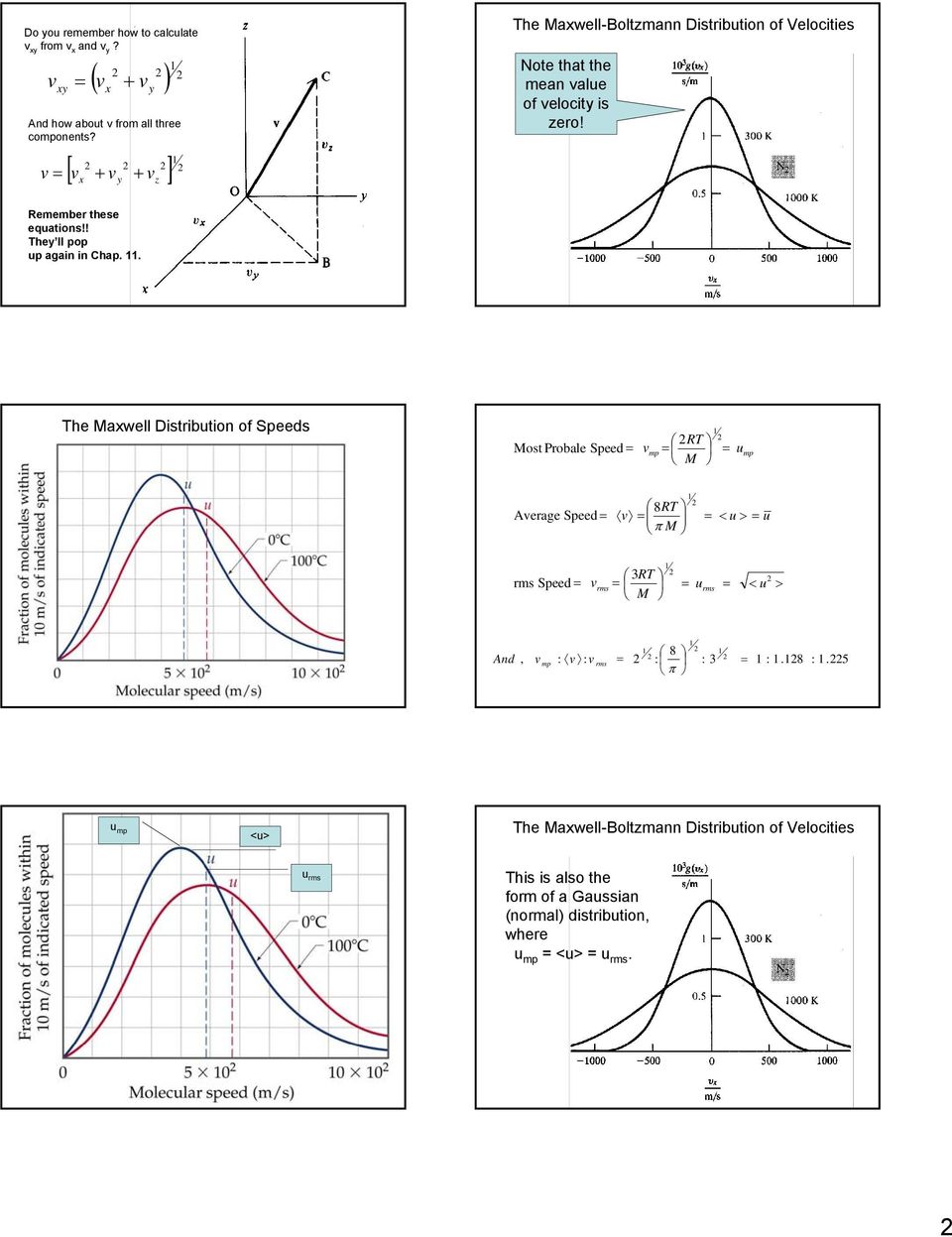
2 Вы помните, как вычислить v xy из v x и v y? xy (v v) v = + А как насчет v из всех трех компонентов? x y Распределение скоростей Максвелла-Больцмана Обратите внимание, что среднее значение скорости равно нулю! [v + v v] v = + x y z Запомните эти уравнения !! Они снова появятся в гл.. Наиболее вероятное распределение скоростей Максвелла Скорость = v mp RT = M = u mp Средняя скорость = 8RT v = π M = = u rms Скорость = v rms 3RT = M = u rms = 8 And, v mp: v: v rms =:: 3 π =: .8: .5 u mp Распределение Максвелла-Больцмана скоростей u rms Это также форма гауссова (нормального) распределения, где u mp = < u> = u среднекв.
3 Применение к законам газа По мере увеличения объема при постоянной температуре средняя кинетика газа остается постоянной.Следовательно, u постоянно. Однако по мере увеличения объема молекулы газа должны перемещаться дальше, чтобы ударить по стенкам контейнера. Следовательно, давление снижается. Если температура увеличивается при постоянном объеме, средняя кинетическая энергия молекул газа увеличивается. Следовательно, происходит больше столкновений со стенками емкости и увеличивается давление. Молекулярная эффузия и диффузия По мере увеличения кинетической энергии скорость молекул газа увеличивается. Средняя кинетическая энергия газа связана с его массой: ε = mu. Рассмотрим два газа с одинаковой температурой: более легкий газ имеет более высокую скорость, чем более тяжелый.Математически: u = 3RT M Молекулярный истощение и диффузия Чем меньше молярная масса M, тем выше среднеквадратичное значение u rms. 3RT M = u rms ОБРАЗЕЦ УПРАЖНЕНИЯ 0.4 Вычисление среднеквадратичной скорости Рассчитайте среднеквадратичную скорость u молекулы N при 5 ° C. Анализ решения: нам известны газ и температура — две величины, которые мы необходимо рассчитать среднеквадратичную скорость. План: мы рассчитаем среднеквадратичную скорость, используя уравнение 0 .. M Решение: Используя уравнение 0., мы должны преобразовать каждую величину в единицы СИ, чтобы все единицы были совместимы.Мы также будем использовать R в единицах Дж / моль-К (Таблица 0), чтобы единицы отменялись правильно. (Эти единицы вытекают из того факта, что J = кг-м / с) 3RT u rms = Комментарий: соответствует скорости 50 миль / час. Поскольку средний молекулярный вес молекул воздуха немного больше, чем у N, среднеквадратичная скорость молекул воздуха немного ниже, чем у N. Скорость, с которой звук распространяется в воздухе, составляет около 350 м / с, то есть около двух. 1/3 средней среднеквадратичной скорости молекул воздуха. Закон истечения Грэма По мере увеличения кинетической энергии скорость молекул газа увеличивается.Выпот — это выход газа через крошечное отверстие. Скорость излияния может быть определена количественно. Закон истечения Грэма. Рассмотрим два газа с молярными массами M и M, относительная скорость истечения определяется как: r M = r M Только те молекулы, которые попадают в маленькое отверстие, вылетают через него. Следовательно, чем выше среднеквадратичное значение, тем больше вероятность попадания молекулы газа в отверстие. 3

4 ОБРАЗЕЦ УПРАЖНЕНИЯ 0.5. Применение закона Грэма. Неизвестный газ, состоящий из одноядерных двухатомных молекул, истекает со скоростью, всего лишь в разы превышающей скорость O при той же температуре. Вычислите молярную массу неизвестного и определите ее. Анализ решения: нам дается скорость истечения неизвестного газа относительно скорости O, и нас просят определить молярную массу и идентичность неизвестного. Таким образом, нам нужно связать относительные скорости излияния с относительными молярными массами. План: мы можем использовать закон излияния Грэма, уравнение 0.3, чтобы определить молярную массу неизвестного газа. Если мы допустим rx и представим скорость излияния и молярную массу неизвестного газа, уравнение 0.3 можно записать следующим образом: Решение: исходя из предоставленной информации, ОБРАЗЕЦ УПРАЖНЕНИЯ 0.5, продолжение. Теперь мы решаем неизвестную молярную массу, потому что нам сказали что неизвестный газ состоит из гомоядерных двухатомных молекул, это должен быть элемент. Молярная масса должна равняться удвоенному атомному весу атомов неизвестного газа. Делаем вывод, что неизвестный газ — это I.ПРАКТИЧЕСКОЕ УПРАЖНЕНИЕ Рассчитайте соотношение скоростей излияния Таким образом, закон излияния Грэхема. Рассмотрим два газа с молярными массами M и M, относительная скорость излияния определяется как: 3RT ru MM = = = ru 3RT MM Только те молекулы, которые попадают в небольшое отверстие выйдет через него. Следовательно, чем выше среднеквадратичное значение, тем больше вероятность попадания молекулы газа в отверстие. Диффузия и длина свободного пробега. Диффузия газа — это распространение газа в пространстве. Для молекул легкого газа диффузия идет быстрее.Распространение происходит значительно медленнее, чем среднеквадратичная скорость (представьте, что кто-то открывает флакон духов: требуется время, чтобы обнаружить запах, но среднеквадратичная скорость при 5 ° C составляет около 50 миль / час). Диффузия замедляется за счет столкновения молекул газа друг с другом. Диффузия и длина свободного пробега Среднее расстояние молекулы газа между столкновениями называется средней длиной свободного пробега. На уровне моря длина свободного пробега составляет около см. Реальные газы: отклонения Из уравнения идеального газа мы имеем PV = n RT или PV nrt Для моля газа PV / nRT = для всех давлений.В реальном газе PV / nRT значительно варьируется от и называется Z. Z = PV nrt. Чем выше давление, тем больше отклонение от идеального поведения. = 4

5 Реальные газы: отклонения Из уравнения идеального газа мы имеем PV = n RT Для моля газа PV / RT = для всех температур. С повышением температуры газы ведут себя более идеально. Допущения кинетической молекулярной теории показывают, где нарушается поведение идеального газа: молекулы газа имеют конечный объем; молекулы газа притягиваются друг к другу.Реальные газы: отклонения По мере увеличения давления газа молекулы сближаются. По мере того, как молекулы сближаются, объем контейнера становится меньше. Чем меньше емкость, тем больше места начинают занимать молекулы газа. Следовательно, чем выше давление, тем меньше газ похож на идеальный. Реальные газы: отклонения Чем ближе молекулы газа, тем меньше межмолекулярное расстояние. Реальные газы: отклонения Чем меньше расстояние между молекулами газа, тем больше вероятность возникновения сил притяжения между молекулами.Следовательно, чем газ меньше похож и на идеальный газ. С повышением температуры молекулы газа перемещаются все быстрее и дальше друг от друга. Кроме того, более высокие температуры означают, что больше энергии доступно для разрушения межмолекулярных сил. 5
6 Настоящие газы: отклонения Таким образом, чем выше температура, тем идеальнее газ. Реальные газы: отклонения Уравнение Ван-дер-Ваальса Мы добавляем два члена к уравнению идеального газа: один для поправки на объем молекул, а другой для поправки на межмолекулярное притяжение. Поправочные члены генерируют уравнение Ван-дер-Ваальса: nrt na P = V nb V где a и b — эмпирические константы, характерные для каждого газа.Реальные газы: отклонения Уравнение Ван-дер-Ваальса nrt na P = V nb V Поправки на молекулярный объем Поправки на молекулярное притяжение Общая форма уравнения Ван-дер-Ваальса: na P + (V nb) = nrt V ПРИМЕР УПРАЖНЕНИЯ 0.6 Использование ван дер Уравнение Ваальса Если бы 000 моль идеального газа было ограничено 4 л при 0,0 ° C, он оказал бы давление в 000 атм. Используйте уравнение Ван-дер-Ваальса и константы в таблице 0.3, чтобы оценить давление, оказываемое 000 моль Cl (г) на 4 л при 0,0 C. Анализ раствора. Величина, которую нам нужно найти, — это давление.Поскольку мы будем использовать уравнение Ван-дер-Ваальса, мы должны определить соответствующие значения для констант, которые там появляются. План: Используя уравнение 0.6, мы получаем ПРИМЕР УПРАЖНЕНИЯ 0.6 (продолжение) Комментарий: Обратите внимание, что первый член, 0,003 атм, представляет собой давление, скорректированное на молекулярный объем. Это значение выше идеального значения, 0,000 атм, потому что объем, в котором молекулы могут свободно перемещаться, меньше объема контейнера, 0,4 л. Таким образом, молекулы должны чаще сталкиваться со стенками контейнера.Второй фактор, 0,03 атм, корректирует межмолекулярные силы. Межмолекулярное притяжение между молекулами снижает давление до атм. Таким образом, мы можем заключить, что межмолекулярные притяжения являются основной причиной небольшого отклонения Cl (g) от идеального поведения в указанных экспериментальных условиях. Решение: подставив n = 0,000 моль, R = L-атм / моль-K, T = 73. K, V = 0,4 л, a = 6,49 л — атм / моль и b = л / моль: Проверить: We ожидайте давление недалеко от 000 атм, что было бы значением для идеального газа, поэтому наш ответ кажется очень разумным.6

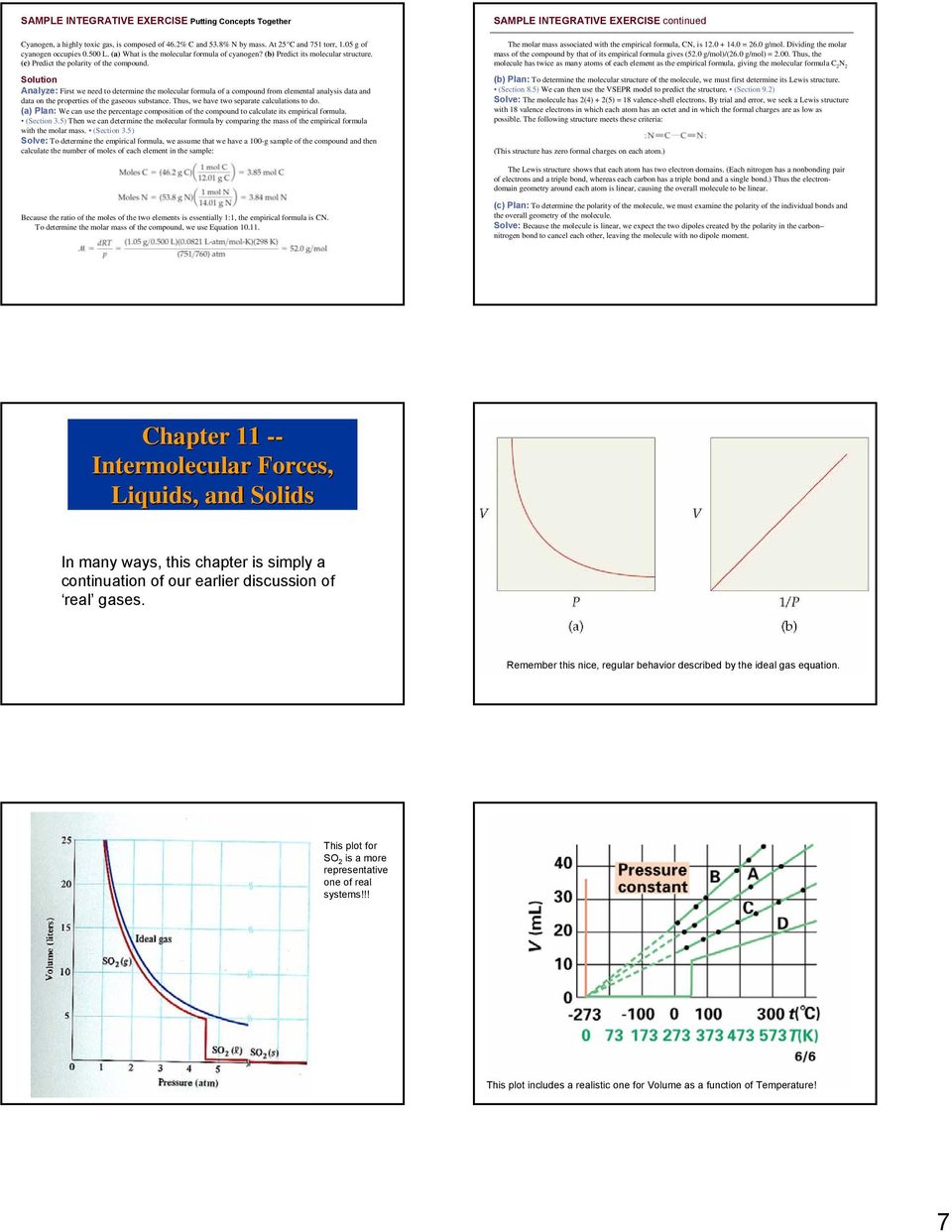
7 ОБРАЗЕЦ КОМПЛЕКСНОГО УПРАЖНЕНИЯ Объединение концепций Цианоген, высокотоксичный газ, состоит из 46% C и 53,8% N по массе. При 5 ° C и 75 торр. 0,05 г цианогена занимает L. (а) Какова молекулярная формула цианогена? (б) Предсказать его молекулярную структуру. (c) Предсказать полярность соединения. Анализ решения: Сначала нам нужно определить молекулярную формулу соединения на основе данных элементного анализа и данных о свойствах газообразного вещества.Таким образом, у нас есть два отдельных вычисления. (а) План: мы можем использовать процентный состав соединения для расчета его эмпирической формулы. (Раздел 3.5) Затем мы можем определить молекулярную формулу, сравнив массу эмпирической формулы с молярной массой. (Раздел 3.5) Решение: чтобы определить эмпирическую формулу, мы предполагаем, что у нас есть образец соединения массой 00 г, а затем вычисляем количество молей каждого элемента в образце: ОБРАЗЕЦ ИНТЕГРАТИВНОЕ УПРАЖНЕНИЕ (продолжение) Молярная масса, связанная с эмпирическим формула CN = 6.0 г / моль. Разделив молярную массу соединения на его эмпирическую формулу, получим (5,0 г / моль) / (6,0 г / моль) = 0,00. Таким образом, в молекуле содержится вдвое больше атомов каждого элемента, чем в эмпирической формуле, что дает молекулярную формулу C N (b) План: Чтобы определить молекулярную структуру молекулы, мы должны сначала определить ее структуру Льюиса. (Раздел 8.5) Затем мы можем использовать модель VSEPR для прогнозирования структуры. (Раздел 9.) Решение: молекула имеет (4) + (5) = 8 электронов валентной оболочки. Методом проб и ошибок мы ищем структуру Льюиса с 8 валентными электронами, в которой каждый атом имеет октет и в которой формальные заряды как можно меньше.Этим критериям соответствует следующая структура: (Эта структура имеет нулевые формальные заряды на каждом атоме.) Структура Льюиса показывает, что каждый атом имеет два электронных домена. (У каждого азота есть несвязывающая пара электронов и тройная связь, тогда как у каждого углерода есть тройная связь и одинарная связь.) Таким образом, геометрия электронного домена вокруг каждого атома является линейной, в результате чего молекула в целом является линейной. Поскольку соотношение молей двух элементов по существу:, эмпирическая формула — CN. Чтобы определить молярную массу соединения, мы используем уравнение 0.. (c) План: чтобы определить полярность молекулы, мы должны исследовать полярность отдельных связей и общую геометрию молекулы. Решение: поскольку молекула линейна, мы ожидаем, что два диполя, созданные полярностью связи углерод-азот, нейтрализуют друг друга, оставляя молекулу без дипольного момента. Глава — Межмолекулярные силы, жидкости и твердые тела Во многих отношениях эта глава является просто продолжением нашего предыдущего обсуждения реальных газов. Помните это красивое, регулярное поведение, описываемое уравнением идеального газа.Этот график для ТАК является более репрезентативным для реальных систем !!! Этот график включает реалистичный график зависимости объема от температуры! 7
8 Почему различаются точки кипения? Есть что-нибудь систематическое? Каковы важные межмолекулярные силы, то есть силы между молекулами? Что определяет, существует ли вещество в виде газа, жидкости или твердого тела? Здесь задействованы два основных фактора: кинетическая энергия частиц.Сила притяжения между частицами. Обратите внимание, что в предыдущих главах основное внимание уделялось внутримолекулярным силам, внутренним силам молекулы. Важные из них: ион-ион, ион-диполь, диполь-диполь, диполь, индуцированный диполь, аналогичный атомным системам (пересмотрите определение диполей). Силы дисперсии Лондона: (индуцированный диполь-индуцированный диполь), связанный с поляризуемостью ван-дер-Ваальсовых сил. Относительные энергии водородных связей. Взаимодействие Как узнать относительную силу каждого из них? Практически невозможно экспериментально !!! Однако самое важное: определите, какие из них присутствуют.Лондонские силы рассеяния: всегда. Все остальные зависят от такого свойства, как существующий диполь для d-d. В некоторых случаях удалось рассчитать относительную силу. d-d d-id disp Ar N C 6 H C 3 H HCl 6 06 CH Cl SO H O HCN

9 Первичным фактором здесь являются лондонские дисперсионные силы. Ион-дипольные взаимодействия. Четвертый тип сил, ион-дипольные взаимодействия, являются важной силой в растворах ионов.Сила этих сил позволяет ионным веществам растворяться в полярных растворителях. Диполь-дипольные силы Давайте подробнее рассмотрим эти взаимодействия: Ион-дипольное взаимодействие 9

10 Диполь-дипольные взаимодействия. Это самый простой. Но мы также должны учитывать другие формы. Обзор гибридизации и молекулярных форм. Диполь-дипольные взаимодействия Помните обсуждение sp, sp и sp 3 гибридизации? Поляризованный атом He с индуцированной дипольной молекулой F Cl Br I CH 4 поляризуемость молекулярный вес Молекулярный вес предсказывает тенденции в точках кипения атомов или молекул без дипольных моментов, поскольку поляризуемость имеет тенденцию увеличиваться с увеличением массы.Лондонские дисперсионные силы или индуцированный диполем диполь 0
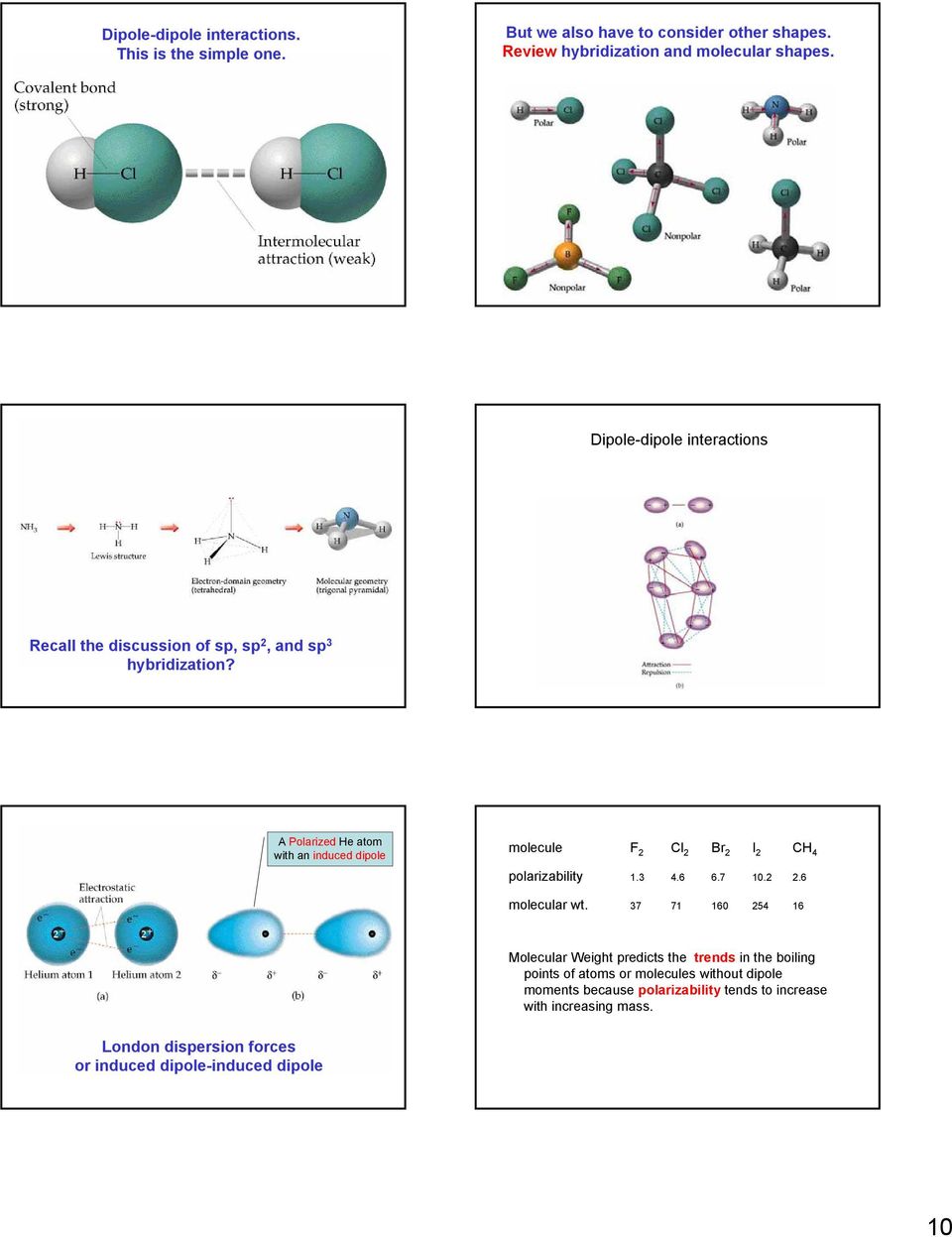
11 Вода — лучший пример водородной связи. Но поляризуемость зависит также от формы, как и от МВ. Вода также необычна по относительной плотности жидкой и твердой фаз. Эти точки кипения демонстрируют огромный вклад водородных связей. Но водородные связи не ограничиваются водой: кристаллическая структура предполагает причину необычно высокой плотности льда.

12 Но вода — не единственное вещество, демонстрирующее водородные связи! .3 Некоторые свойства жидкостей Вязкость Сопротивление жидкости Вязкость сопротивление течению жидкости, такой как масло, вода, бензин, патока, (стекло !!!) Поверхностное натяжение: тенденция минимизировать площадь поверхности сравните воду, ртуть. Силы когезии связывают похожие молекулы вместе. Силы сцепления связывают вещество с поверхностью. Капиллярное действие, возникающее, когда эти два фактора не равны потоку, называется вязкостью.Это связано с легкостью, с которой молекулы могут проходить мимо друг друга. Вязкость увеличивается с увеличением межмолекулярных сил и уменьшается с повышением температуры. Мыло снижает поверхностное натяжение, позволяя одному материалу легче смачивать другой. Единица СИ — кг / м-с. Во многих таблицах до сих пор используется старая единица вязкости, пуаз, которая представляет собой г / см-с, с типичными значениями, указанными как cp = 0,0 P. Поверхностное натяжение Поверхностное натяжение является результатом чистой внутренней силы, испытываемой молекулами на поверхности жидкость.Обоснование поверхностного натяжения

13 Поверхностное натяжение Поверхностные молекулы притягиваются только внутрь к объемным молекулам. Следовательно, поверхностные молекулы упакованы более плотно, чем объемные. Поверхностное натяжение — это количество энергии, необходимое для увеличения площади поверхности жидкости, в Дж / м. Силы когезии связывают молекулы друг с другом. Адгезионные силы связывают молекулы с поверхностью.Мениск поверхностного натяжения — это форма поверхности жидкости. Если силы сцепления превышают силы сцепления, поверхность жидкости притягивается к контейнеру больше, чем объемные молекулы. Следовательно, мениск имеет U-образную форму (например, вода в стакане). Если силы сцепления превышают силы сцепления, мениск изгибается вниз. Капиллярное действие: когда узкая стеклянная трубка помещается в воду, мениск вытягивает воду вверх по трубке. Помните, что поверхностные молекулы притягиваются только внутрь к объемным молекулам.Фазовые переходы Сублимация: твердый газ. Испарение: сжиженный газ. Плавка или плавление: твердая жидкость. Осаждение: твердый газ. Конденсация: газ и жидкость. Замораживание: жидкое твердое вещество. также называется FUSION H vap: 40 670 Дж / моль ОБРАЗЕЦ УПРАЖНЕНИЯ.4 Расчет H для изменения температуры и фаз Рассчитайте изменение энтальпии при преобразовании 0,00 моль льда при 5 ° C в водяной пар (пар) при 5 ° C и постоянном давлении атм. . Удельная теплота льда, воды и пара составляет 09 Дж / г-К, 4,8 Дж / г-К и 84 Дж / г-К соответственно.Для H O H fus = 6,0 кДж / моль и H vap = кДж / моль. H fus: 6,00 Дж / моль C p (s): 37,6 Дж / моль-K C p (л): 7,4 Дж / моль-K C p (г): 33. Дж / моль-K Анализ раствора: Наш Цель состоит в том, чтобы рассчитать общее количество тепла, необходимое для преобразования моль льда при 5 ° C в пар при 5 ° C. План: мы можем рассчитать изменение энтальпии для каждого сегмента, а затем просуммировать их, чтобы получить общее изменение энтальпии (закон Гесса, раздел 5.6. ). Решение: для сегмента AB на рисунке 9 мы добавляем достаточно тепла ко льду, чтобы повысить его температуру на 5 ° C. Изменение температуры на 5 ° C аналогично изменению температуры на 5 K, поэтому мы можем использовать удельную теплоемкость льда для расчета изменения энтальпии во время этого процесса: Для сегмента BC на рисунке.9, в котором мы преобразуем лед в воду при 0 C, мы можем напрямую использовать молярную энтальпию плавления: изменения энтальпии для сегментов CD, DE и EF можно рассчитать аналогичным образом: 3

14 ПРИМЕР УПРАЖНЕНИЯ.4 (продолжение) Общее изменение энтальпии — это сумма изменений отдельных шагов: Проверка: компоненты общего изменения энергии приемлемы по сравнению с длинами горизонтальных сегментов линий на рисунке.9. Обратите внимание, что самый большой компонент — это теплота испарения. 5 Давление пара, объясняющее давление пара на молекулярном уровне, летучесть, давление пара и температуру; Давление пара и точка кипения. 6 Фазовые диаграммы Фазовые диаграммы HO и CO. 7 Структуры твердых тел Единичные ячейки Кристаллическая структура хлорида натрия Плотная упаковка сфер. 8 Связывание в твердых телах Молекулярные твердые тела Ковалентно-сетчатые твердые тела Ионные твердые тела Металлические твердые тела Глава 3 Свойства растворов 3. Изменение энергии процесса раствора и образование раствора Образование раствора, спонтанность и беспорядок Образование раствора и химические реакции Наблюдение за давлением пара: а при более высоких температурах vp выше.Та же картина полезна для рационализации давления пара. Когда стакан накрыт, равновесие быстро устанавливается. 4

15 Нормальное АД определено Контрастность с непокрытым стаканом! Но вспомните определение ЛЮБОЙ точки кипения. Но, напомним, мы всегда предпочитаем прямые линии! ln P vap Hvap = + C R T (Добавьте слайд формулы C-C и нанесите на график.) Темп. увеличивается. Используя уравнение Клаузиуса-Клапейрона: табулируйте P в атм и T в K; Рассчитайте lnp и / T График lnp vs / T Наклон равен = — H vap / R Или, если P — давление пара при T, а P — давление пара при TH ln P = R vap, вычтите, чтобы получить H vap + Cand ln P = + CTRTH vap ln P ln P = RTT или PH vap ln = PRTT Наклон! 5
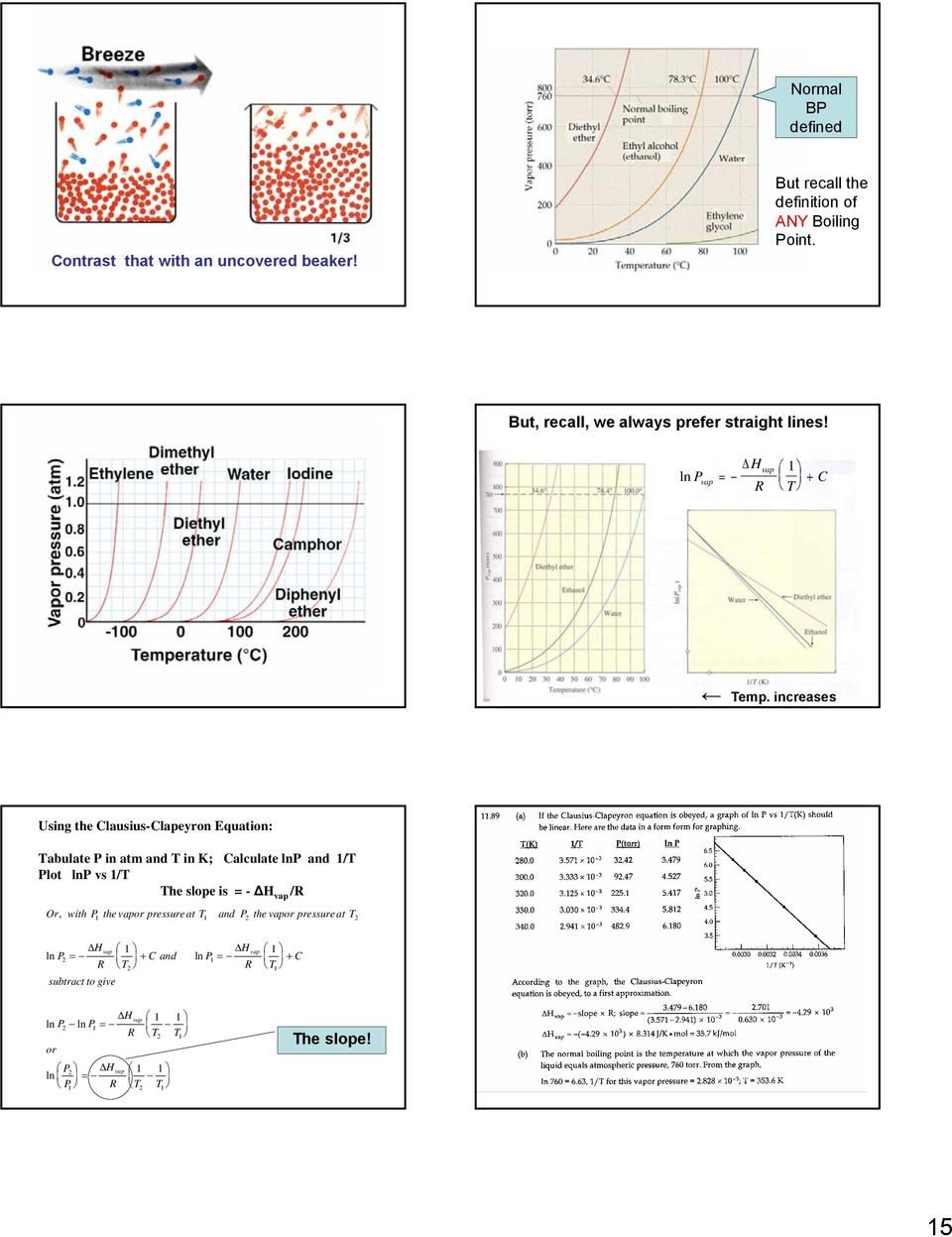
.
