Транскрипция и трансляция, подготовка к ЕГЭ по биологии
И транскрипция, и трансляция относятся к матричным биосинтезам. Матричным биосинтезом называется синтез
биополимеров (нуклеиновых кислот, белков) на матрице — нуклеиновой кислоте ДНК или РНК. Процессы матричного биосинтеза относятся к пластическому обмену: клетка расходует энергию АТФ.
Матричный синтез можно представить как создание копии исходной информации на несколько другом или новом
«генетическом языке». Скоро вы все поймете — мы научимся достраивать по одной цепи ДНК другую, переводить РНК в ДНК
и наоборот, синтезировать белок с иРНК на рибосоме. В данной статье вас ждут подробные примеры решения задач, генетический словарик пригодится — перерисуйте его себе :)
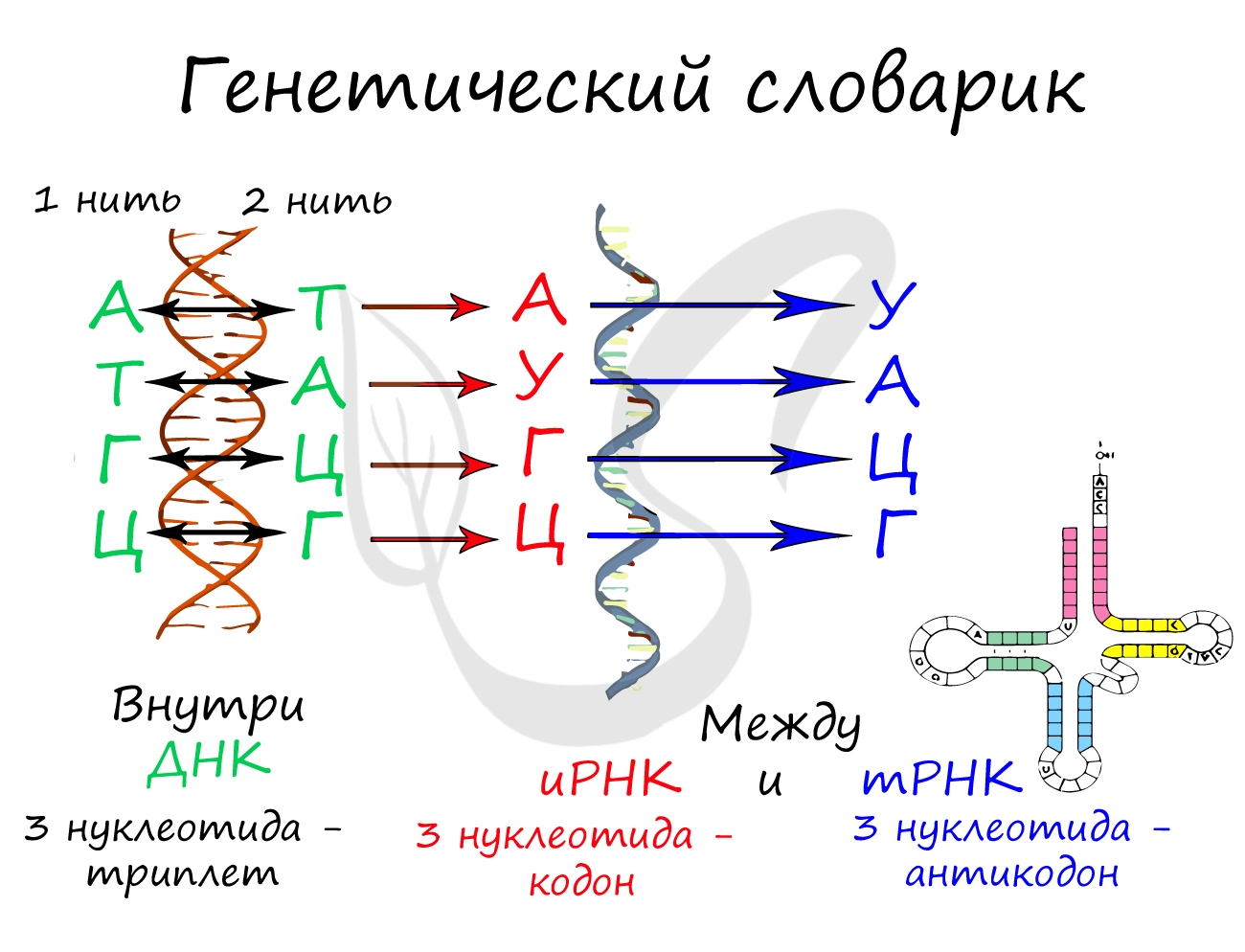
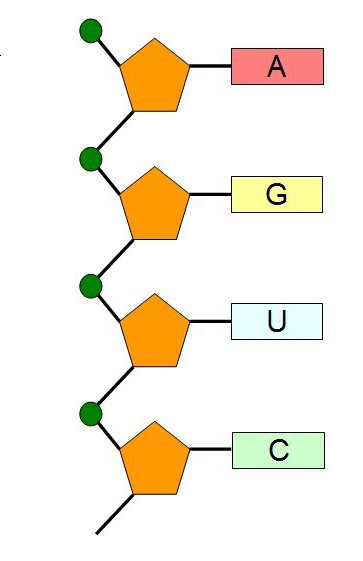
Возьмем 3 абстрактных нуклеотида ДНК (триплет) — АТЦ. На иРНК этим нуклеотидам будут соответствовать — УАГ (кодон иРНК).
тРНК, комплементарная иРНК, будет иметь запись — АУЦ (антикодон тРНК). Три нуклеотида в зависимости от своего расположения
будут называться по-разному: триплет, кодон и антикодон. Обратите на это особое внимание.
Репликация ДНК — удвоение, дупликация (лат. replicatio — возобновление, лат. duplicatio — удвоение)
Процесс синтеза дочерней молекулы ДНК по матрице родительской ДНК. Нуклеотиды достраивает фермент ДНК-полимераза по
принципу комплементарности. Переводя действия данного фермента на наш язык, он следует следующему правилу: А (аденин) переводит в Т (тимин), Г (гуанин) — в Ц (цитозин).
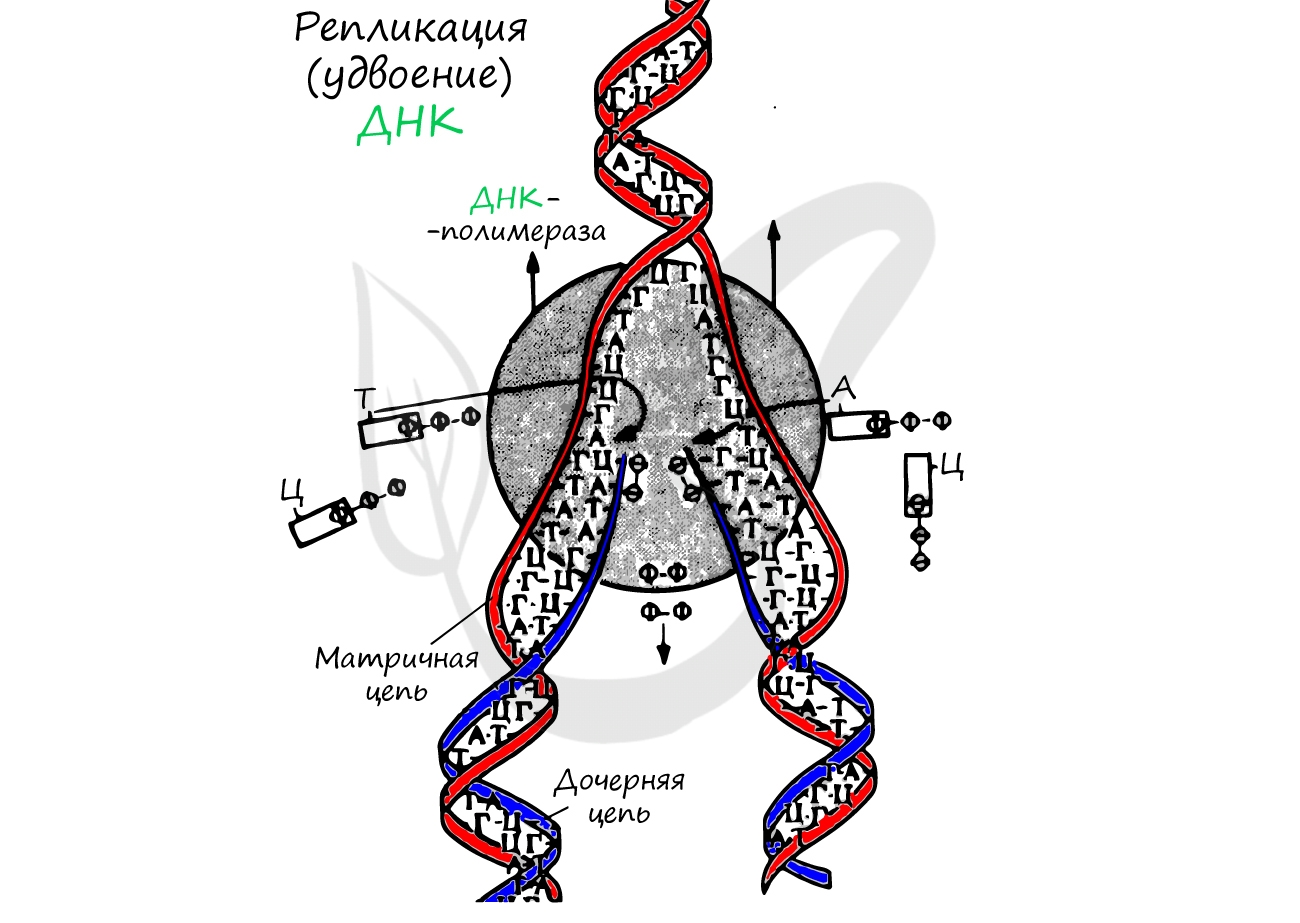
Удвоение ДНК происходит в синтетическом периоде интерфазы. При этом общее число хромосом не меняется, однако каждая из них
содержит к началу деления две молекулы ДНК: это необходимо для равномерного распределения генетического материала между
дочерними клетками.
Транскрпиция (лат. transcriptio — переписывание)
Транскрипция представляет собой синтез информационной РНК (иРНК) по матрице ДНК. Несомненно, транскрипция происходит
в соответствии с принципом комплементарности азотистых оснований: А — У, Т — А, Г — Ц, Ц — Г (загляните в «генетический словарик»
выше).
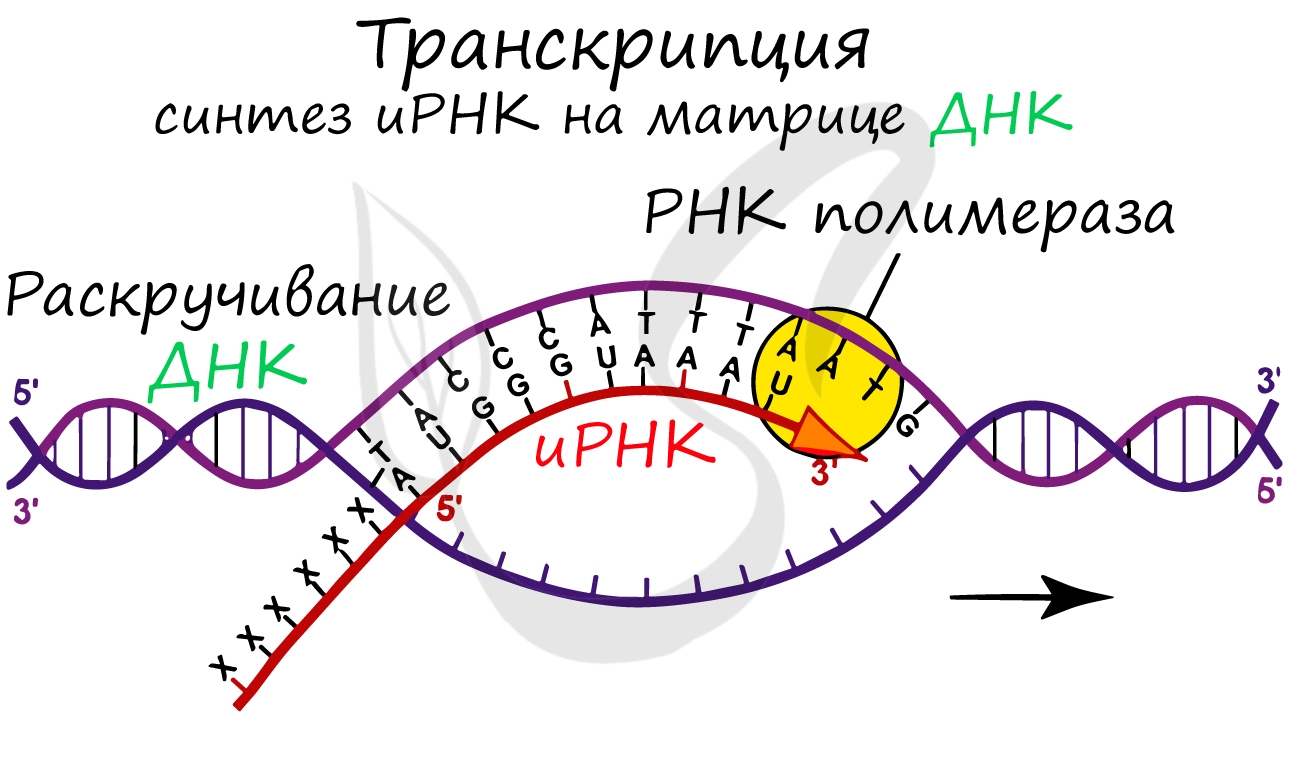
До начала непосредственно транскрипции происходит подготовительный этап: фермент РНК-полимераза узнает особый участок молекулы ДНК — промотор и связывается с ним. После связывания с промотором происходит раскручивание молекулы ДНК, состоящей из двух
цепей: транскрибируемой и смысловой. В процессе транскрипции принимает участие только транскрибируемая цепь ДНК.
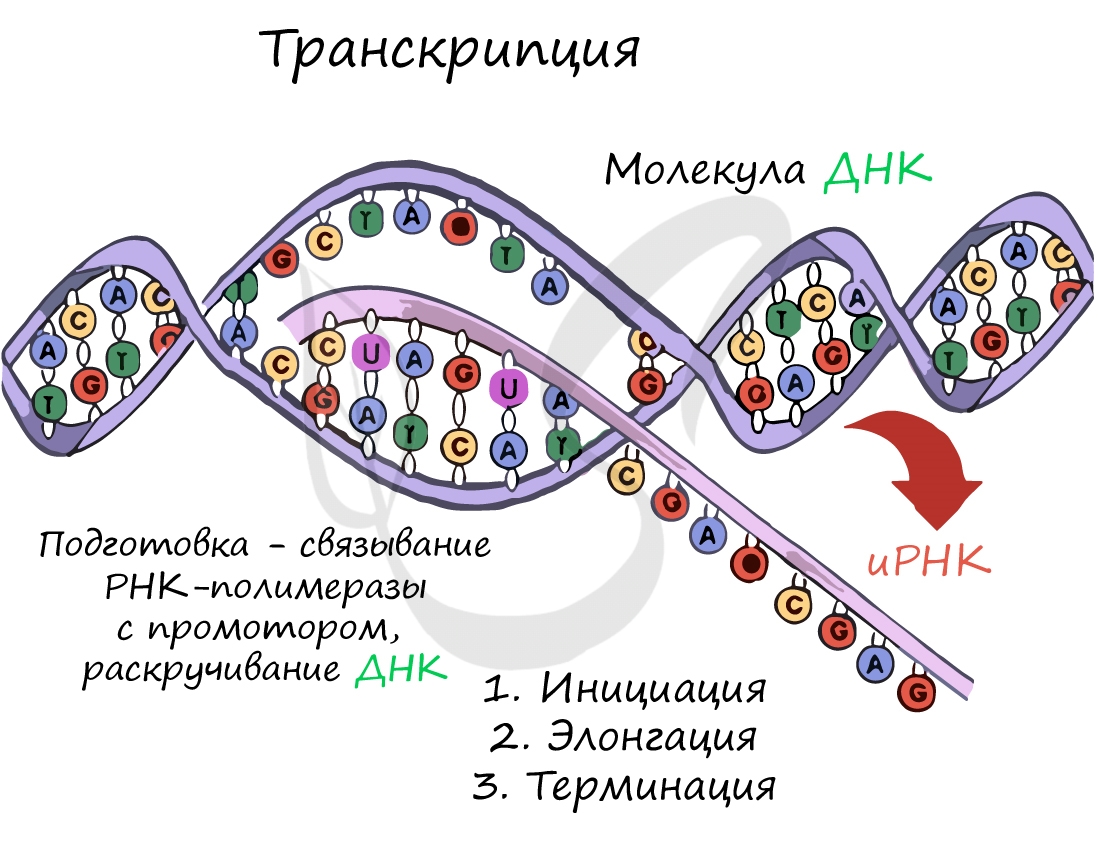
Транскрипция осуществляется в несколько этапов:
- Инициация (лат. injicere — вызывать)
- Элонгация (лат. elongare — удлинять)
- Терминация (лат. terminalis — заключительный)
Образуется несколько начальных кодонов иРНК.
Нити ДНК последовательно расплетаются, освобождая место для передвигающейся РНК-полимеразы. Молекула иРНК
быстро растет.
Достигая особого участка цепи ДНК — терминатора, РНК-полимераза получает сигнал к прекращению синтеза иРНК. Транскрипция завершается. Синтезированная иРНК направляется из ядра в цитоплазму.
Трансляция (от лат. translatio — перенос, перемещение)
Куда же отправляется новосинтезированная иРНК в процессе транскрипции? На следующую ступень — в процесс трансляции.
Он заключается в синтезе белка на рибосоме по матрице иРНК. Последовательность кодонов иРНК переводится в последовательность
аминокислот.
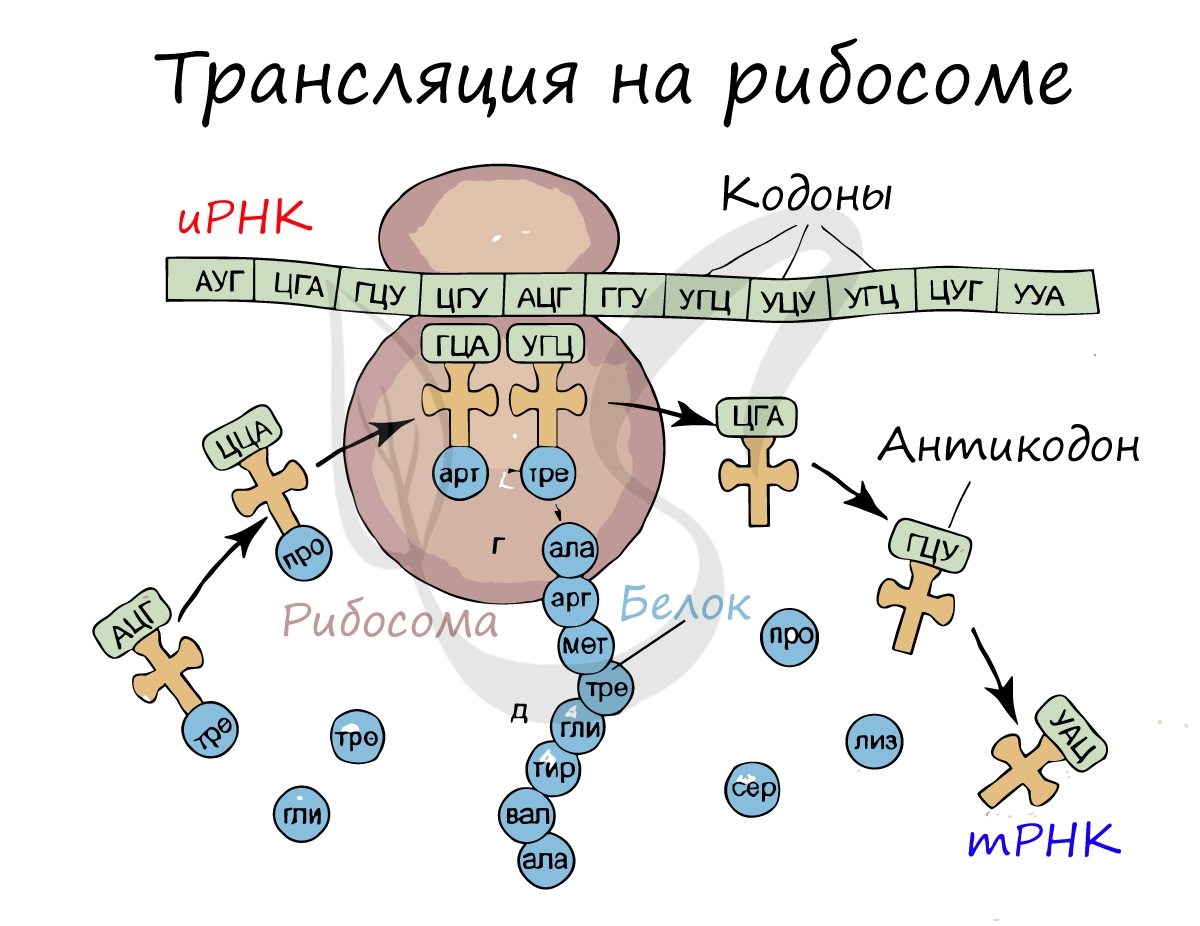
Перед процессом трансляции происходит подготовительный этап, на котором аминокислоты присоединяются к соответствующим молекулам тРНК. Трансляцию можно разделить на несколько стадий:
- Инициация
- Элонгация
- Терминация
Информационная РНК (иРНК, синоним — мРНК (матричная РНК)) присоединяется к рибосоме, состоящей из двух субъединиц.
Замечу, что вне процесса трансляции субъединицы рибосом находятся в разобранном состоянии.
Первый кодон иРНК, старт-кодон, АУГ оказывается в центре рибосомы, после чего тРНК приносит аминокислоту,
соответствующую кодону АУГ — метионин.
Рибосома делает шаг, и иРНК продвигается на один кодон: такое в фазу элонгации происходит десятки тысяч раз.
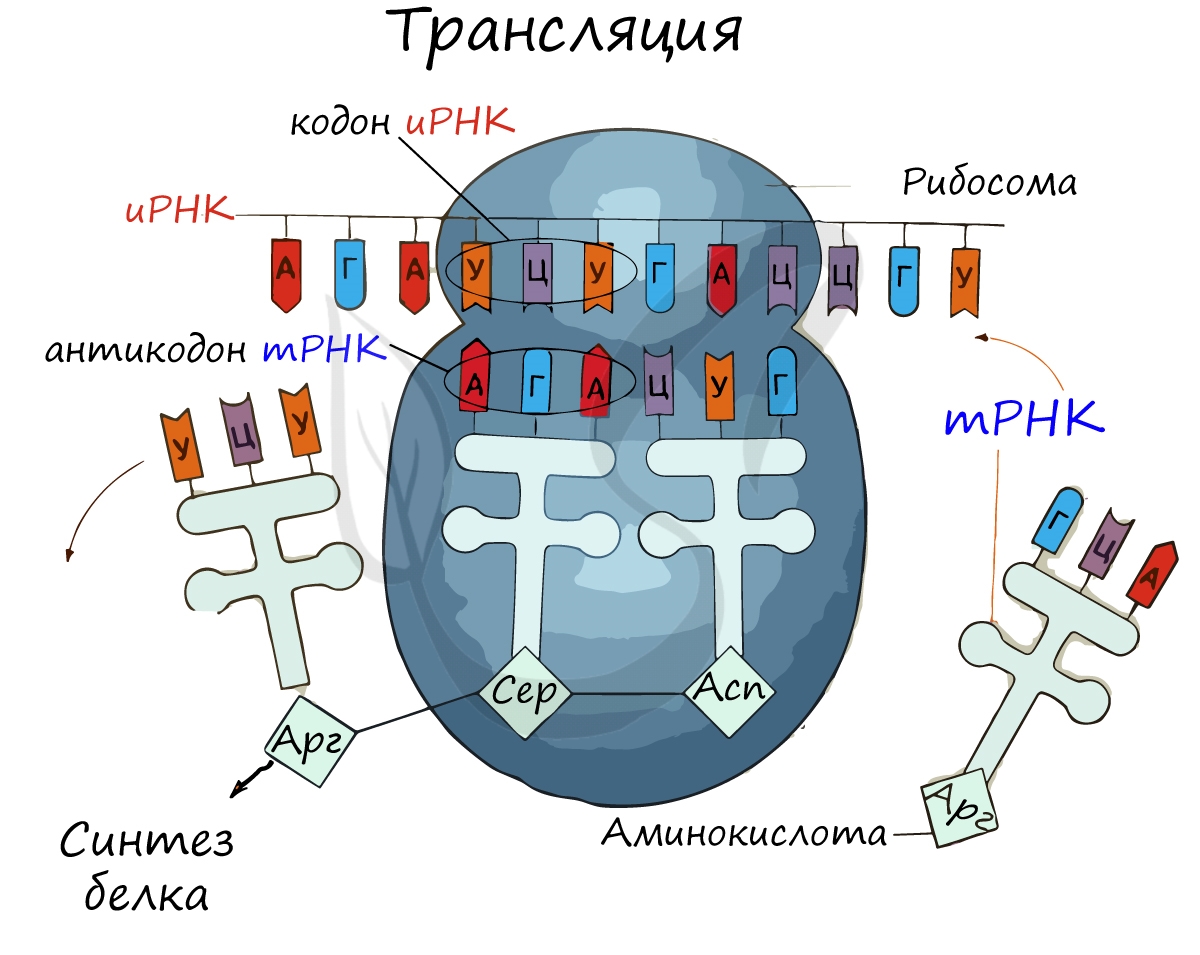
Молекулы тРНК приносят новые аминокислоты, соответствующие кодонам иРНК. Аминокислоты соединяются друг с другом: между ними образуются пептидные связи, молекула белка растет.
Доставка нужных аминокислот осуществляется благодаря точному соответствию 3 нуклеотидов (кодона) иРНК 3 нуклеотидам (антикодону) тРНК. Язык перевода между иРНК и тРНК выглядит как: А (аденин) — У (урацил), Г (гуанин) — Ц (цитозин).
В основе этого также лежит принцип комплементарности.
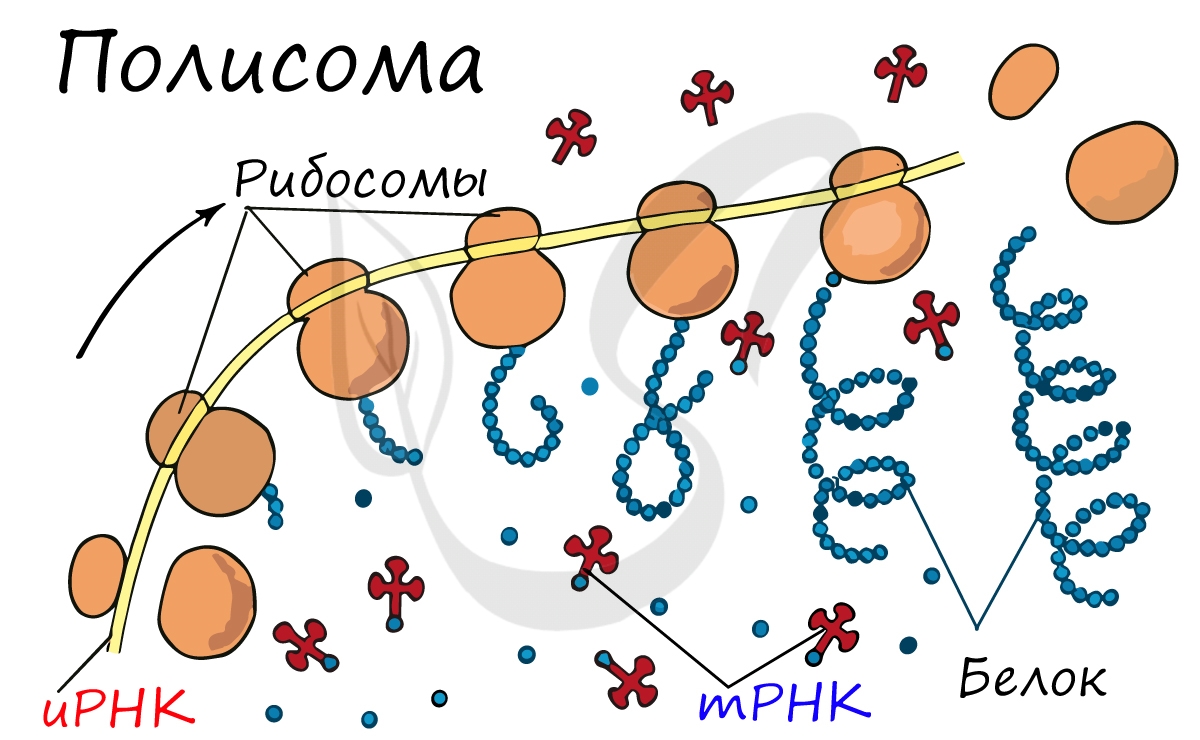
Движение рибосомы вдоль молекулы иРНК называется транслокация. Нередко в клетке множество рибосом садятся на одну молекулу
иРНК одновременно — образующаяся при этом структура называется полирибосома (полисома). В результате происходит одновременный синтез множества одинаковых белков.
Синтез белка — полипептидной цепи из аминокислот — в определенный момент завершатся. Сигналом к этому служит попадание
в центр рибосомы одного из так называемых стоп-кодонов: УАГ, УГА, УАА. Они относятся к нонсенс-кодонам (бессмысленным), которые не кодируют ни одну аминокислоту. Их функция — завершить синтез белка.
Существует специальная таблица для перевода кодонов иРНК в аминокислоты. Пользоваться ей очень просто, если вы запомните, что
кодон состоит из 3 нуклеотидов. Первый нуклеотид берется из левого вертикального столбика, второй — из верхнего горизонтального,
третий — из правого вертикального столбика. На пересечении всех линий, идущих от них, и находится нужная вам аминокислота :)
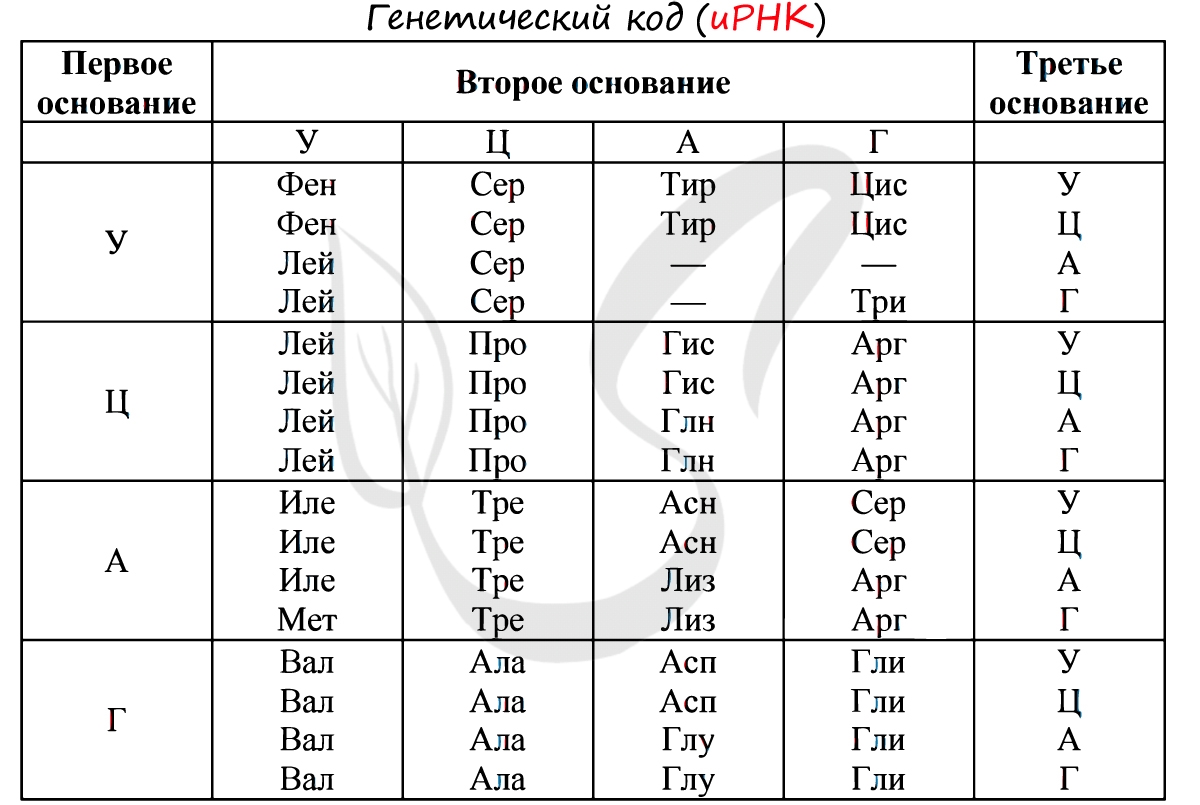
Давайте потренируемся: кодону ЦАЦ соответствует аминокислота Гис, кодону ЦАА — Глн. Попробуйте самостоятельно найти
аминокислоты, которые кодируют кодоны ГЦУ, ААА, УАА.
Кодону ГЦУ соответствует аминокислота — Ала, ААА — Лиз. Напротив кодона УАА в таблице вы должны были обнаружить прочерк:
это один из трех нонсенс-кодонов, завершающих синтез белка.
Примеры решения задачи №1
Без практики теория мертва, так что скорее решим задачи! В первых двух задачах будем пользоваться таблицей генетического кода (по иРНК),
приведенной вверху.
«Фрагмент цепи ДНК имеет следующую последовательность нуклеотидов: ЦГА-ТГГ-ТЦЦ-ГАЦ. Определите последовательность нуклеотидов
во второй цепочке ДНК, последовательность нуклеотидов на иРНК, антикодоны
соответствующих тРНК и аминокислотную последовательность соответствующего фрагмента молекулы белка, используя таблицу генетического кода»

Объяснение:
По принципу комплементарности мы нашли вторую цепочку ДНК: ГЦТ-АЦЦ-АГГ-ЦТГ. Мы использовали следующие правила при нахождении второй нити
ДНК: А-Т, Т-А, Г-Ц, Ц-Г.
Вернемся к первой цепочке, и именно от нее пойдем к иРНК: ГЦУ-АЦЦ-АГГ-ЦУГ. Мы использовали следующие правила при переводе ДНК в иРНК:
А-У, Т-А, Г-Ц, Ц-Г.
Зная последовательность нуклеотидов иРНК, легко найдем тРНК: ЦГА, УГГ, УЦЦ, ГАЦ. Мы использовали следующие правила перевода иРНК в тРНК:
А-У, У-А, Г-Ц, Ц-Г. Обратите внимание, что антикодоны тРНК мы разделяем запятыми, в отличие кодонов иРНК. Это связано с тем, что
тРНК представляют собой отдельные молекулы (в виде клеверного листа), а не линейную структуру (как ДНК, иРНК).
Пример решения задачи №2
«Известно, что все виды РНК синтезируются на ДНК-матрице. Фрагмент цепи ДНК, на которой синтезируется участок центральной петли тРНК, имеет
следующую последовательность нуклеотидов: ТАГ-ЦАА-АЦГ-ГЦТ-АЦЦ. Установите нуклеотидную последовательность участка тРНК, который синтезируется
на данном фрагменте, и аминокислоту, которую будет переносить эта тРНК в процессе биосинтеза белка, если третий триплет соответствует антикодону
тРНК»

Обратите свое пристальное внимание на слова «Известно, что все виды РНК синтезируются на ДНК-матрице. Фрагмент цепи ДНК, на которой
синтезируется участок центральной петли тРНК «. Эта фраза кардинально меняет ход решения задачи: мы получаем право напрямую и сразу
синтезировать с ДНК фрагмент тРНК — другой подход здесь будет считаться ошибкой.
Итак, синтезируем напрямую с ДНК фрагмент молекулы тРНК: АУЦ-ГУУ-УГЦ-ЦГА-УГГ. Это не отдельные молекулы тРНК (как было
в предыдущей задаче), поэтому не следует разделять их запятой — мы записываем их линейно через тире.
Третий триплет ДНК — АЦГ соответствует антикодону тРНК — УГЦ. Однако мы пользуемся таблицей генетического кода по иРНК,
так что переведем антикодон тРНК — УГЦ в кодон иРНК — АЦГ. Теперь очевидно, что аминокислота кодируемая АЦГ — Тре.
Пример решения задачи №3
Длина фрагмента молекулы ДНК составляет 150 нуклеотидов. Найдите число триплетов ДНК, кодонов иРНК, антикодонов тРНК и
аминокислот, соответствующих данному фрагменту. Известно, что аденин составляет 20% в данном фрагменте (двухцепочечной
молекуле ДНК), найдите содержание в процентах остальных нуклеотидов.

Один триплет ДНК состоит из 3 нуклеотидов, следовательно, 150 нуклеотидов составляют 50 триплетов ДНК (150 / 3). Каждый триплет ДНК
соответствует одному кодону иРНК, который в свою очередь соответствует одному антикодону тРНК — так что их тоже по 50.
По правилу Чаргаффа: количество аденина = количеству тимина, цитозина = гуанина. Аденина 20%, значит и тимина также 20%.
100% — (20%+20%) = 60% — столько приходится на оставшиеся цитозин и гуанин. Поскольку их процент содержания равен, то
на каждый приходится по 30%.
Теперь мы украсили теорию практикой. Что может быть лучше при изучении новой темы? :)
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Трансляция
☰
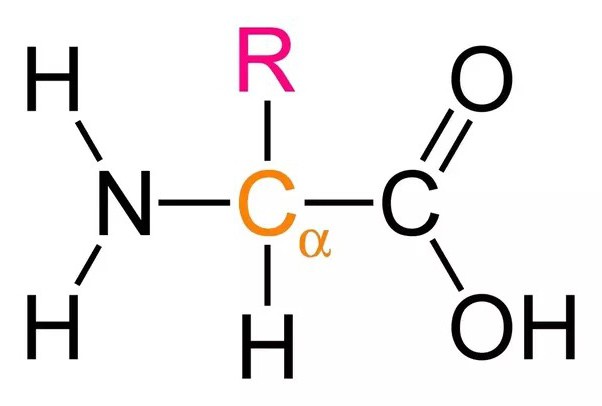
Под трансляцией в биологии понимают синтез из аминокислот полипептидов, который протекает в цитоплазме на рибосомах при участии 1) мРНК в качестве матрицы, 2) тРНК в качестве переносчика аминокислот, а также 3) ряда белковых факторов, выполняющих каталитическую функцию на разных этапах процесса. Трансляция протекает в клетках всех живых организмов, это фундаментальный процесс живой природы.
С информационной точки зрения трансляцию можно определить как механизм перевода последовательности триплетов мРНК в последовательность аминокислот белка.
Функция рибосом состоит в удерживании в нужном положении мРНК, тРНК и белковых факторов до тех пор, пока не произойдет определенная химическая реакция. Чаще всего это образование пептидной связи между соседними аминокислотами.
Трансляция и биосинтез белка обычно означают одно и то же. Однако, когда говорят о биосинтезе белка, то нередко в него включают посттрансляционные модификации полипептидов (приобретение ими вторичной, третичной и четверичной структур), а также иногда могут включать процесс транскрипции. С этой точки зрения трансляция рассматривается как важный этап в биосинтезе белков.
Процесс трансляции у эукариот и прокариот имеет ряд отличий, в основном связанный с разнообразием и активностью белковых факторов.
На одной цепочке мРНК может находится несколько рибосом, образуя полисому. При этом сразу происходит синтез нескольких идентичных полипептидов (но каждый находится на своей стадии синтеза).
Синтез одного белка обычно длится несколько секунд.
Аминокислоты, из которых синтезируется полипептид, обязательно проходят стадию активации. Сам же процесс трансляции включает три стадии: инициацию, элонгацию и терминацию.
Процесс трансляции обладает свойством специфичности. Во-первых, определенным кодонам мРНК соответствуют свои тРНК. Во вторых, аминокислоты присоединяются только к «своим» тРНК.
Активация аминокислот
Активация аминокислот необходима, так как только в таком состоянии они способны соединяться с тРНК и позже образовывать между собой пептидные связи.
В цитоплазме клеток всегда находятся свободные (не соединенные с другими веществами) аминокислоты. Специфичные ферменты в присутствии АТФ преобразуют аминокислоту в аминоациладенилат, который уже способен соединяться с тРНК.
Существует класс ферментов – аминоацил-тРНК-синтетазы, – которые активируют аминокислоты, используя при этом энергию АТФ. Каждая аминокислота активируется своим ферментом, после чего присоединяется только к своей тРНК. Образуется комплекс аминокислоты с тРНК – аминоацил-тРНК (аа-тРНК).
Инициация трансляции
Инициация трансляции включает следующие последовательно протекающие при участии факторов инициации этапы:
Присоединение 5′-конца мРНК к малой субъединице рибосомы. При этом стартовый кодон (AUG) размещается в недостроенном (из-за отсутствия большой субъединицы) P-сайте рибосомы.
Комплекс аа-тРНК с соответствующим антикодоном присоединяется к стартовому кодону мРНК. У эукариот кодон AUG кодирует аминокислоту метионин, у прокариот — формил-метионин. Позже эти стартовые аминокислоты вырезаются из готового полипептида.
Происходит объединение субъединиц рибосом, в результате чего достраиваются их P- и A-сайты.
Схема строения рибосомы (A, P, E — участки-сайты для молекул тРНК)
Таким образом, на этапе инициации происходит распознавание рибосомой стартового кодона и подготовка к началу синтеза.
Образующаяся связь между рибосомой и мРНК обратима, мРНК после синтеза полипептида может быть отсоединена от рибосомы. В последствии мРНК используется еще раз или разрушается специальными ферментами.
Стартовый кодон AUG отличается от других таких же кодонов в середине мРНК тем, что перед ним находится кэп и определенные нуклеотидные последовательности. Именно благодаря им AUG распознается как стартовый. (Это касается в основном эукариот.)
Элонгация трансляции
На этом этапе происходит непосредственный синтез полипептидной цепочки. Процесс элонгации состоит из множества циклов. Один цикл элонгации — это присоединение одной аминокислоты к растущей полипептидной цепочке.
Уже на этапе инициации P-сайт рибосомы оказывается занятым первой тРНК, несущей аминокислоту метионин. В первом цикле элонгации в A-сайт рибосомы заходит второй комплекс aa-тРНК. Это будет та тРНК, чей антикодон комплементарен следующему (за стартовым AUG) кодону.
A(аминоацил)- и P(пептидил)-сайты располагают комплексы аа-тРНК так, что между аминокислотами протекает химическая реакция, и образуется пептидная связь.
После этого первая (находящаяся в P-сайте) тРНК освобождается от своей аминокислоты. В результате последняя оказывается связанной только со второй аминокислотой пептидной связью. Вторая аминокислота связана со второй тРНК, находящейся в A-сайте.
Рибосома перемещается по нити мРНК на один триплет. При этом первая т-РНК оказывается в E-сайте (exit) рибосомы, после чего покидает ее. Вторая т-РНК, связанная с двумя аминокислотами, переходит в P-сайт. A-сайт освобождается для поступления третьего комплекса аа-тРНК.
Следующие циклы элонгации протекают аналогично первому. Когда A-сайт освобождается, в него может зайти аа-тРНК, чей антикодон комплементарен кодону мРНК, находящемся в этот момент в A-сайте.
Терминация трансляции
Терминация — это завершения синтеза полипептидной цепочки и ее отделение. Терминация наступает, когда рибосома встречает один из терминирующих кодонов (UAA, UAG, UGA), для которых не существует своих тРНК. Эти участки мРНК распознаются специальными белками — факторами терминации.
Трансляция
Трансляция
Трансляция — это процесс, в результате которого рибосомы считывают генетическую информацию матричных РНК и создают белковый продукт в соответствии с этой информацией.
Специфические молекулы транспортрых РНК (тРНК) служат посредниками между кодом мРНК и конечной белковой последовательностью. В их состав входит последовательность, узнающая код мРНК и соответствующая этому коду аминокислота.
События трансляции разделяют на последующие события: инициацию, элонгацию и терминацию. На стадии инициации рибосома связывает мРНК и первая аминокислота присоединяется к рибосоме. Во время элонгации происходит рост полипептидной цепи. На стадии терминации рибосома отделяется от мРНК и процес трансляции заканчивается. У прокариот и эукариот процессы трансляции схожи, но имеются и существенные различия.
Трансляция происходит в цитоплазме, где находятся рибосомы. В зависимости от дальнейшего преднозначения синтезируемых белков, они могут образовываться либо в цитозоле, либо на поверхности шероховатого эндоплазматического ретикулума.
Полипептидные цепи синтезируются однонаправленно: с амино-конца к карбокси-концу.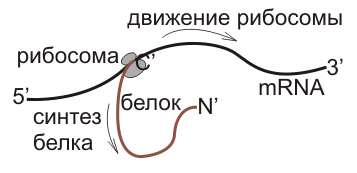
При инициации первая и вторая молекулы аминоацил-тРНК спариваются с первыми двумя кодонами мРНК. Далее трансляция продолжается в направлении 5’–>3′ кодон за кодоном до тех пор, пока не достигнет стоп-сигнала, расположенного сразу же за кодоном, детерминирующим С-концевую аминокислоту.
Литература:
К сожалению, список литературы отсутствует.
Литература:
К сожалению, список литературы отсутствует.
Вместо комплементарного РНК-РНК узнавания, в которое вовлечена прединициирующая последовательность Шайна-Дальгарно прокариотических мРНК, эукариотические мРНК узнаются эукариотическими рибосомами по кэпированному 5′-концу с обязательным участием белка, например, eIF-4F инициаторного фактора ( Rhoads, 1988 ). Предполагается, что этот белок участвует в расплавлении вторичных структур 5′- областей мРНК, облегчая их связывание с малыми субчастицами рибосом. В отличие от прокариот, эукариотическая мРНК образует комплексы с белками ( мРНП , или мессенджер-рибонуклеопротеиды, или информосомы ), что обусловливает ее метаболическую стабильность. Вследствие этого у эукариот отсутствует постоянная интенсивная деградация и интенсивный ресинтез мРНК, которые, как правило, моноцистронны и имеют специфически модифицированный (кэпированный) 5′-конец. Все это обусловливает целый ряд особенностей инициации трансляции и ее регуляции у эукариотических организмов. Естественно, что метаболическая стабильность эукариотической мРНК делает регуляцию на уровне трансляции особенно важной в общей картине регуляции биосинтеза белка ( Спирин, 1986 ).
Литература:
К сожалению, список литературы отсутствует.
 Трансляция бактерии E.coli наиболее изучена
Трансляция бактерии E.coli наиболее изучена
Синтез белка происходит на рибонуклеопротеиновом комплексе — рибосоме, в процессе трансляции mRNA. Рибосома состоит из большой и малой субъединиц, которые соединены в области инициации трансляции (translation initiation region -TIR) mRNA во время стадии инициации трансляции. Во время элонгации рибосома скользит вдоль mRNA и синтезирует полипептидную цепь. Элонгация продолжается до тех пор, пока рибосома не достигает стоп-кодона на mRNA — терминация трансляции. После терминации рибосома отделяется от синтезированного полипептида и способна снова повторить цикл трансляции mRNA.
Каждая стадия трансляции имеет свои регуляторные факторы, но у эукариот этих факторов гораздо больше, чем у прокариот.
Инициация
Инициация
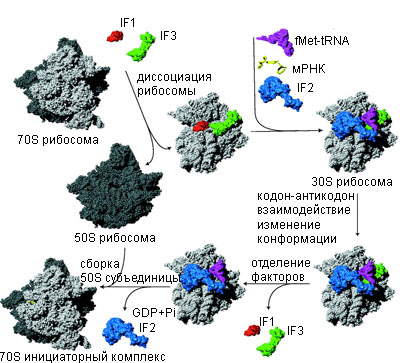 Последовательность инициации трансляции у бактерии. 30S и 50S рибосомные субъединицы показаны светлым и темным серым цветом. [Laursen, et al. 2005]
Последовательность инициации трансляции у бактерии. 30S и 50S рибосомные субъединицы показаны светлым и темным серым цветом. [Laursen, et al. 2005]
Рибосомы прокариот инициируют трансляцию на мРНК уже во время транскрипции. Время необходимое для посадки рибосом порядка секунд, хотя это зависит от каждой мРНК. Рибосомы транслируют мРНК со скоростью приблизительно 12 аминокислот в секунду.
В инициации трансляции участвуют: рибосома, аминоацилированная и формилированная тРНК (fMet-tRNAfMet), мРНК и три белковых инициирующих фактора IF1, IF2 и IF3.
Бактериальная 70S рибосома состоит из большой 50S и малой 30S субъединицы. Имеется три tRNA связывающих сайта аминоацил — aminoacyl (A), пептидил — peptidyl (P), и сайт выхода — exit (E). Присоединение фактора IF3 к 30S рибосомной субъединице обеспечивает распад рибосомы на субъединицы. Фактор инициации IF1 связывается с A-сайтом 30S рибосомной субъединицы и служит инициатором присоединения tRNA к рибосомному P-сайту блокируя A-сайт. IF1 стимулирует активность IF3 и также распад рибосомных субъединиц.
После распада субъединиц, IF2, mRNA и fMet-tRNAfMet соединяются с 30S рибосомной субъединицей. Последовательность Шайно-Дальгарно (Shine-Dalgamo -SD) mRNA взаимодействует с anti-SD последовательностью 16S rRNA и инициирующий кодон присоединяется в Р-сайте рибосомы. Инициирующие факторы, особенно IF3, способствуют этому присоединению.
Инициаторная tRNA устанавливается в P-сайте 30S рибосомной субъединицы в три шага не зависимо от кодона, зависимо от кодона и fMet-tRNAfMet присоединение.
Все три шага обеспечиваются фактором IF2, который взаимодействует с fMet-tRNAfMet на рибосоме. IF3 стабилизирует присоединение fMet-tRNAfMet к рибосомному P-сайту и стабилизирует кодон-антикодон взаимодействие.
30S преинициаторный комплекс состояций из 30S рибосомной субъединицы, трех инициаторных факторов, mRNA в стартовой позиции, где fMet-tRNAfMet связана кодон независимо. Такой относительно нестабильный комплекс подвергается конформационному изменению, что обеспечивает кодон-антикодон взаимодействие и формирует более стабильный 30S инициаторный комплекс. Инициаторные факторы IF1 и IF3 отсоединяются, тогда как IF2 фактор стимулирует взаимодействие с 50S рибосомной субъединицей. После сборки рибосомы IF2 покидает комплекс. Во время этого процесса GTP связанный с IF2 гидролизуется до GDP и Pi. Вновь образованный 70S инициаторный комплекс, содержащий fMet-tRNAfMet как субстрат для пептидилтрансферазного центра 50S рибосомной субъединицы готов к вступлению в фазу элонгации трансляции.
Факторы инициации: IF-1, IF-2, IF-3 — белки временно связывающиеся с рибосомой, необходимые для инициации.
Этапы инициации трансляции
:
1. Факторы инициации IF-1 и IF-3 связываются с 30S-субчастицей, что обеспечивает ее взаимодействие с IF-2, инициаторной формилметиониновой-тРНК (Fmet-тРНКFMet) и GTP.
2. При связывании инициаторных белков IF-1 и IF-2 с 30S-субчастицей происходит диссоциация 70S-рибосомы на две субъединицы.
3. Комплекс 30S-субъединицы со всеми факторами инициации и Fmet-тРНКFMet связывается с 5′-концом мРНК вблизи кодона AUG и узнает. AUG-кодон мРНК.
Связывание 30S-субчастицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно
за 10 нуклеотидов до 5′-конца инициаторного кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами по следовательности из 5-8н, называемой последовательностью Шайна-Дальгарно, с полипиримидиновым участком, находящимся вблизи 3′-конца 16S-pPHK.
4. Формирование полноценного функционального комплекса инициации завершается ассоциацией 50S-субчастицы с преинициаторным комплексом. При ассоциации 70S-рибосомы образуются два активных центра: Р- и А-участки. Fmet-TPHKFMet занимает Р-участок.
5. С образованием функциональной 70S-субчастицы отделяются все три белка инициации.
Элонгация
Факторы элонгации: EF-Tu и EF-Ts — белки связывающиеся с рибосомой, необходимые для элонгации трансляции.
В процессе инициации образуется 70S-рибосома связанная с мРНК, в Р-центре которой находится Fmet-тPHKFMet
Для образования первой пептидной связи необходимо, чтобы
аминоацил-тРНК, соответствующая следующему кодону, заняла А-центр.
Этапы элонгации трансляции:
1. EF-Tu-GTP связывает все аминоацил-тРНК, кроме Fmet-тPHKFMet, и доставляет их к А-центру комплекса 70S-рибосома-мРНКАминоацил-тРНК связывает EF-Tu и GTP. Образовавшийся комплекс (аминоацил-тРНК-[ЕF-Тu-GТР]) доставляет аминоацил-тРНК к А-участку. GTP гидролизуется, и комплекс (EF-Tu-GDP) отделяется от рибосомы. EF-Ts восстанавливает EF-Tu-GDP.
2. Когда оба участка, А и Р, заняты, пептидилтрансферазная активность 50S-субчастицы катализирует перенос группы Fmet с ее тРНК на аминогруппу аминоацил-тРНК, находящейся в А-участке. В результате в А-участке оказывается дипептидил-тРНК, а в Р – свободная тРНК.
3. тРНК освобождает Р-участок, образовавшаяся дипептидил-тРНК переместиться на него, а новый кодон должен быть готов к тому, чтобы занять освободившийся А-участок. Все эти процессы
осуществляются с помощью EF-G при GTP-зависимой транслокации рибосомы.
4. Теперь новый кодон, занявший А-сайт, готов к спариванию с родственной аминоацил-тРНК. Сразу после связывания аминоацил-тРНК с А-
участком высвобождается комплекс EF-Tu-GDP и происходит регенерация функционально активного EF-Tu-GTP. При этом EF-Tu-GDP взаи- модействует с белком EF-Ts, что приводит к отделению GDP и образованию комплекса EF-Tu•EF-Ts. Далее EF-Tu•EF-Ts взаимодействует с GTP, происходит регенерация EF-Tu-GTP и отделение EF-Ts, и оба соединения оказываются готовыми к следую- щему циклу.
Для прочтения следующего кодона и удлинения полипептидной цепи еще на одну аминокислоту вся серия реакций должна повториться.
При образовании каждой пептидной связи расходуется энергия, равная четырем энергетическим эквивалентам (если за один эквивалент принять энергию образования фосфатной связи): два эквивалента АТР потребляются при аминоацилировании тРНК и два эквивалента GTP-
в каждом цикле элонгации.
2. При инициации трансляции IF-2 узнает Fmet-тРНКFMet среди всех других аминоацил-тРНК, a EF-Tu отличает met-тРНКF Met от
Fmet-тРНКM Met при внедрении в А-участок.
3. Факторы элонгации EF-Tu и EF-G то присоединяются, то отделяются от рибосомы в зависимости от того, связаны ли они с GTP или с GDP соответственно.
4. Растущая полипептидная цепь всегда соединена своим карбоксильным концом с тРНК, которая соответствует С-концевой аминокислоте в растущей полипептидной цепи.
5. Пептидилтрансфераза катализирует формирование пептидных связей между карбоксильным концом растущей цепи и аминогруппой аминоацил-тРНК.
Терминация
Факторы терминации:
RF-1 вызывает отделение полипептидной цепи при считывании кодонов UAA и UAG;
RF-2 действует аналогичным образом при считывании UAA и UGA,
EF-3 может облегчить работу двух других факторов.
Этапы терминации трансляции:
1. В А-участке оказывается один из трех терминирующих кодонов – UAG, UAA или UGA. Из-за отсутствия тРНК, отвечающих этим кодонам,полипептидил-тРНК остается связанной с Р-участком.
2. RF-1 и RF-2 катализируют отсоединение полипептидной цепи от тРНК, отделение их обоих от рибосомы, а 70S-рибосомы – от мРНК.
RF-1 узнает в А-участке кодон UAA или UAG; RF-2 включается в том случае, когда в А-участке оказы-вается UAA или UGA;
RF-3 облегчает работу двух других факторов. Если терминирующим кодономявляется UAA, то эффективность процесса терминации оказывается наибольшей, поскольку этот кодон узнают оба фактора – RF-1 и RF-2. Однако, каким бы из стоп-кодонов ни обеспечивалась терминация,ее эффективность зависит от фланкирующих эти кодоны последовательностей в мРНК.
Когда расстояние от рибосомы до сайта инициации достигнет величины 100–200 нуклеотидов, в этом сайте может произойти новая инициация трансляции. Таким образом на одной мРНК
может находится несколько транслирующих рибосом — полирибосомы (рис)
Характерискика рибосом
 Рибосомы
Рибосомы
эукариот: 80S, размер — 22×32 нм,
M ~4.5 млн.Да состоит из двух субъединиц.
Большая субъединица М=3.0млн.Да, 60S
[1rRNA 5S (~120н), 1рРНК 5.8S (~160н), 1rRNA 28S (4800н),
45-50 белковых молекул].
Малая субъединица
М=1.5 млн.Да, 40S [1rRNA18S (1900н), 30-35
белковые молекулы].
В цитоплазме эукариотической клетки содержится ~10 млн. рибосом
эукариотического типа.
Рибосомы прокариот:
70S, размер — 21×29 нм, М ~2.8 млн.Да,
состоит из двух субъединиц.
Большая субъединица М=1.8млн.Да 50S
[1rRNA 23S(~2904н), 1rRNA 5S(~120н), 34 белковые молекулы
(L1-L34)].
Малая субъединица М=1.0млн.Да 30S
[1rRNA 16S (~1542н), 21 белковые молекулы (S1-S21)].
В клетке E.coli содержится ~15тыс. рибосом, что составляет
– 1/4 сухой массы клетки. Рибосомы прокариотического типа
присутствуют в митохондриях и пластидах эукариот.
Малые и большие субъединицы могут диссоциировать на составляющие
РНК и белки и самособираются при определенных условиях.
Строение рибосом
Рибосома имеет два участка для связывания тРНК:
Р-центр (пептидил-тРНК-связывающий центр)
— связывание тРНК присоединенной к растущей полипептидной
цепи.
А-центр (аминоацил-тРНК-связывающий участок)
— связвает тРНК несущую следующую добавляемую аминокислоту,
располагается на большой субъединице рибосомы.
Аcn
центр
пептидилтрансфераза –
образует пептидные связи между актами, прочно связывается
с рибосомой.
рибосома
р эукариот 22×32 нм, M~4.5 млн.Да 80S. Большая субъед М=3.0млн.Да, 60S [1rRNA 5S (~120н), 1рРНК 5.8S (~160н), 1rRNA 28S (~5 тыс.н), ~45 белков]; малая субъед М=1.5 млн.Да, 40S.
1rRNA18S (~2 тыс.н),~33 белка] | в цитоплазме Eu ~10 млн.р эукариотич типа |
р прокариот: 21×29 нм, М ~2.8 млн.Да, 70S | большая субъед М=1.8млн.Да 50S[1RNA 23S(~3200н), 1rRNA 5S(~120н), 34белка]; малая субъед М=1.0млн.Да 30S[1rRNA 16S (~1600н), 21 белок] | E.coli ~15тыс р – 1.4 сухой m кл | р прокариотич типа присут в митох и пластидах Eu |
| P-центр пептидил-тРНК-связывающий центр, А-центр большой субъед. р – аминоацил-тРНК-связывающий участок, Аcn центр | пептидилтрансфераза – образ. пептидные связи м-у актами, прочно связан с р | р прокариот мельче и сод меньше компонентов
мРНК [кэп | 5’-НТО | AUG | транслируемая область | стоп 3’-НТО | поли(А)]
инициация сканирование РНК малой субъединицой рибосомы | связывание со стартовым (инициирующим) кодоном AUG-5’ конца – сборка рибосомы | инициаторный комплекс, факторы инициации | Первой к мРНК присоед малая субъед. р связанная с инициаторной-тРНК узнающей AUG и несущей метионин. Процесс катализируется фактором инициации 2 IF2 – фосфорилирование одной из трех его субъед. снижает активность ф-та – контроль белкогого синтеза (незрелые эритроциты) | элонгация 5’?3’ | транслокация – возвращение пустой тРНК в цитоплазму | транслокация рибосомы вдоль мРНК сопровожд. конформационными изменениями с затратой энергии GTP (4GTP вцелом на 1 пепт. связь) | кодон мРНК спаривается с антикодоном тРНК | карбоксильный конец растущего полипептида связан ковалентно с тРНК – пептидил-тРНК | образ. полисомы | терминирующий кодон (стоп-кодон) UAA, UAG, UGA – диссоциация рибосомы – терминация | фактор освобождения-белок связ с стоп-кодоном и меняет активность пептидилтрансферазы кот присоед к пептидил-тРНК Н2О и полипептид отделяется от тРНК и выходит из р | Цикл элонгации составляет 1/20 сек – белок в 300 акт синтезируется за 20 сек Ecoli
Литература:
К сожалению, список литературы отсутствует.
70-90Н | вторичная стр-ра- клеверный лист | CCA 3′ const для всех tRNA |к концевому аденозину присоед акта |
наличие тимина, псевдоуридина-пси, дигироуридина ДГУ в D-петле — защита от рибонуклеаз ? долгоживущие | Разнообразие первичных структур tРНК — 61+1 — по кол-ву кодонов + формилметиониновая tРНК, у кот антикодон такой же, как у метиониновой tРНК. Разнообразие третичных структур — 20 (по кол-ву аминокислот) | рекогниция — образование ковалентной связи м-у tРНК и актой | аминоацил-тРНК-синтетазы присоединяют акты к тРНК
Функция тРНК заключается в переносе аминокислот из цитоплазмы в рибосомы, в которых происходит синтез белков.
тРНК связывающие одну аминокислоту называются изоакцепторными.
Всего в клетке одновременно существует 64 различных тРНК.
Каждая тРНК спаривается только со своим кодоном.
Каждая тРНК распознает свой собственный кодон без участия аминокислоты. Связавшиеся с тРНК аминокислоты химически модифицировали, после чего анализировали получившийся полипептид, который содержал модифицированную аминокислоту. Цистеинил-тРНКCys (R=Ch3-SH) восстанавливали до аланил-тРНКCys (R=Ch4).
Большинство тРНК, не зависимо от их нуклеотидной последовательности, имеют вторичную структуру в форме клеверного листа из-за наличия в ней трех шпилек.
Особенности структуры тРНК
На 3′-конце молекулы всегда находятся четыре неспаренных нуклеотида, причем три из них – это обязательно ССА. 5′- и 3′-концы цепи РНК образуют акцепторный стебель. Цепи удерживают-ся вместе благодаря комплементарному спарива-нию семи нуклеотидов 5′-конца с семью нуклеотида-ми, находящимися вблизи 3′-конца. 2. У всех моле-кул имеется шпилька T?C, обозначаемая так пото-му, что она содержит два необычных остатка: рибо-тимидин (Т) и псевдоуридин (?). Шпилька состоит из двухцепочечного стебля из пяти спаренных осно- ваний, включая пару G-C, и петли длиной семь нуклеотидов. Тринуклеотид Т?С всегда расположен
в одном и том же месте петли. 3. В антикодоновой шпильке стебель всегда представлен семью спарен-
ными основаниями. Триплет, комплементарный родственному кодону,– антикодон – находится в пет-
ле, состоящей из семи нуклеотидов. С 5′-конца антикодон фланкируют инвариантный остаток ура-
цила и модифицированный цитозин, а к его 3′-концу примыкает модифицированный пурин, как правило
аденин. 4. Еще одна шпилька состоит из стебля длиной три-четыре пары нуклеотидов и петли варь-
ирующего размера, часто содержащей урацил в вос-становленной форме – дигидроурацил (DU). Наиболее сильно варьируют нуклеотидные по-следовательности стеблей, число нуклеотидов меж-ду антикодоновым стеблем и стеблем Т?С (вариа-бельная петля), а также размер петли и локализация остатков дигидроурацила в DU-петле.
[Сингер, 1998].
Третичная структура тРНК
L-образная структура.
Присоединение аминокислот к тРНК
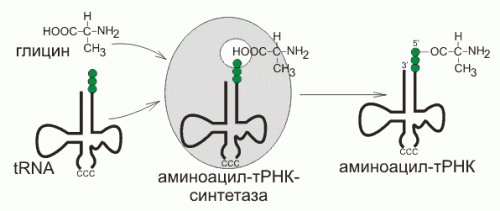 Для того чтобы аминокислота могла образовывать полипептидную цепь она должна присоединиться к тРНК с помощью фермента аминоацил-тРНК-синтетазы. Этот фермент образует ковалентную связь между карбоксильной группой аминокислоты и гидроксильной группой рибозы на 3’-конце тРНК при участии АТФ. Аминоацил-тРНК-синтетаза узнает специфический кодон не из-за наличия антикодона на тРНК, а по наличию специфического сайта узнавания на тРНК.
Для того чтобы аминокислота могла образовывать полипептидную цепь она должна присоединиться к тРНК с помощью фермента аминоацил-тРНК-синтетазы. Этот фермент образует ковалентную связь между карбоксильной группой аминокислоты и гидроксильной группой рибозы на 3’-конце тРНК при участии АТФ. Аминоацил-тРНК-синтетаза узнает специфический кодон не из-за наличия антикодона на тРНК, а по наличию специфического сайта узнавания на тРНК.
Всего в клетке имеется 21 различных аминоацил-тРНК-синтетаз.
Присоединение происходит в две стадии:
1. Карбоксильная группа аминокислоты присоединяется к а-фосфату АТФ. Полученный нестабильный аминоацил-аденилат стабилизируется связываясь с ферментом.
2. Перенос аминоацильной группы аминоацил-аденилата на 2’ или 3’-OH-группу концевой рибозы тРНК
Некоторые аминоацил-тРНК-синтетазы состоят из одной полипептидной цепи, другие – из двух или четырех идентичных цепей, каждая молекулярной массой от 35 до 115 кДа. Некоторые димерные и тетрамерные ферменты состоят из субъединиц двух типов. Четкой корреляции между размером молекулы фермента или характером его субъединичной структуры и специфичностью не существует.
Специфичность фермента определяется его прочным связыванием с акцепторным концом тРНК, DU-участком и вариабельной петлей. Некоторые ферменты, по-видимому, не распознают антикодоновый триплет и катализируют реакцию аминоацетилирования даже при измененном антикодоне. Однако отдельные ферменты проявляют пониженную активность по отношению к таким модифицированным тРНК и при замене антикодона присоединяют не ту аминокислоту.
70-90н | вторичная стр-ра- клеверный лист | CCA 3′ const для всех tRNA |к концевому аденозину присоед акта |
наличие тимина, псевдоуридина-пси, дигироуридина ДГУ в D-петле — защита от рибонуклеаз ? долгоживущие | Разнообразие первичных структур tРНК — 61+1 — по кол-ву кодонов + формилметиониновая tРНК, у кот антикодон такой же, как у метиониновой tРНК. Разнообразие третичных структур — 20 (по кол-ву аминокислот)
Имеются два вида тРНК связывающие метионин тРНКFMet и тРНКMMet у прокариот и, тРНКIMetи тРНКMMet — у эукариот. К каждой тРНК добавляется метионин с помощью соответствующих аминоацил-тРНК-синтетез. метионин присоединенный к тРНКFMet и тРНКIMet формилируется ферментом метионил-тРНК-трансформилазой до Fmet-тРНКFMet. тРНК нагруженные формилметионином узнают инициаторный кодон AUG.
Литература:
К сожалению, список литературы отсутствует.
Трансляция (биология) | Info-Farm.RU
Трансляция — процесс синтеза белков из аминокислот, катализируемой рибосомой на матрице матричной (информационной) РНК (мРНК или иРНК). Трансляция является одной из стадий процесса биосинтеза белков, в свою очередь части процесса экспрессии генов.
Трансляция происходит в цитоплазме, где находятся рибосомы клетки. Во время трансляции, информация, содержащаяся в мРНК, расшифровывается согласно правилам, известными как генетический код, и используется для синтеза закодированной полипептидной последовательности. Процесс трансляции можно разделить на четыре фазы: активацию, инициацию, элонгацию и терминацию.
При активации, соответствующая аминокислота (аа) присоединяется к соответствующей транспортной РНК (тРНК). Хотя эта стадия часто рассматривается отдельно от трансляции, она необходима для ее начала. Связана с аминокислотой тРНК называется аминоацил-тРНК или «заряженной» тРНК. При инициации имела субъединица рибосомы связывается с 5′-концом мРНК с помощью факторов инициации (IF), других белков, помогают процессу. Элонгация происходит, когда очередная аминоацил-тРНК используется для увеличения полипептидной цепочки. Терминация происходит, когда рибосома встречает стоп-кодон (UAA, UAG или UGA), для которого не существует соответствующей тРНК, при этом происходит освобождение полипептидной цепочки.
Механизм трансляции
Общие сведения
Для осуществления процесса трансляции в клетках всех без исключения организмов существуют специальные органеллы — рибосомы. Рибосомы являются рибонуклеопротеиднимы комплексами, построенными из 2 субъединиц: большой и малой. Функция рибосом заключается в распознавании тринуклеотидних кодонов мРНК, подбор соответствующих им аминокислот и присоединении этих аминокислот к белковой цепочки, что растет. Двигаясь вдоль молекулы мРНК, рибосома распознает кодон за кодоном и синтезирует белок в соответствии информации, заложенной в молекуле мРНК.
Для распознавания аминокислот в клетке существуют специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарную кодона мРНК, и другой участок, к которому присоединяется аминокислота, соответствующая этому кодона. Присоединение аминокислот к тРНК осуществляется в екзоенергетичний реакции ферментами аминоацил-тРНК-синтетазами, а молекула, получаемая в результате, называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтеназ, что присоединяют аминокислоты строго к соответствующим им тРНК (например, кодона GGU отвечать тРНК, содержит антикодон CCA, а к этой тРНК будет присоединяться только аминокислота глицин).
Механизмы трансляции прокариот (бактерий и архей) и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотических трансляцию, в значительно меньшей степени действуют на трансляцию эукариотических организмов, что позволяет использовать их в медицинской практике как антибактериальные средства, безопасные для организма млекопитающих.
Поскольку каждый кодон содержит три нуклеотида, один и тот же генетический «текст» можно прочитать тремя разными способами (начиная с первого, второго и третьего нуклеотидов), то есть в трех разных рамках считывания. По некоторым интересными исключениями, значимой является информация, закодированная только в одной рамке считывания. По этой причине крайне важным для синтеза белка рибосомой является ее правильное позиционирование на стартовом AUG-кодоне — при инициации трансляции.
Механизм трансляции прокариот
Инициация
Синтез белка всегда начинается с AUG-кодона, также кодирует метионин. Этот кодон обычно называют стартовым или инициаторним. Инициация трансляции предусматривает узнавание рибосомой этого кодона и привлечение инициаторной аминоацил-тРНК. Для инициации трансляции необходимо также наличие определенных нуклеотидных последовательностей в районе стартового кодона. Существование последовательности, отличающей стартовый AUG от внутренних, совершенно необходимо, поскольку иначе инициация синтеза белка происходила бы хаотично на всех AUG-кодонов.
Процесс инициации обеспечивается специальными белками — факторами инициации (англ. Initiation factors, сокращенно IF).
Малая рибосомная субъединица (30S) прокариот, если она не вовлечена в это время в трансляцию, существует в комплексе с факторами инициации IF1, IF3 и, в некоторых случаях, IF2:
- IF3, связанный с 30S-субъединицей, предотвращает ассоциации с большой (50S) субъединицей рибосомы, тем самым сохраняя ее свободное состояние до связывания с матричной РНК. Этот белок также участвует в связывании мРНК и тРНК, а также IF2.
- IF2 взаимодействует с тРНК, а также обладает способностью расщеплять ГТФ.
- IF1 является, видимо, не обязательным фактором (у некоторых видов он отсутствует) повышающим сродство малой субъединицы к IF2 и IF3.
Комплекс 30S субъединицы с инициаторным факторами способен распознавать специальные последовательности мРНК, так называемые участки связывания рибосомы (англ. Ribosomt-binding site или RBS). Эти участки содержат, во-первых, инициаторний кодон AUG и, во-вторых, специальную последовательность Шайн-Дальгарно, с которой комплементарно связывается рибосомная 16S РНК. Последовательность Шайн-Дальгарно служит для того, чтобы отличить инициаторным AUG от внутренних кодонов, кодирующих метионин. После того, как 30S-субъединица связалась с мРНК, к ней привлекается инициаторным аминоацил-тРНК и IF2, если они еще не были включены в комплекс. Затем присоединяется 50S-субъединица, происходит гидролиз ГТФ и диссоциация факторов инициации. Собранная рибосома начинает синтезировать полипептидную цепочку.
Элонгация
Элонгация полипептидной цепочки заключается в добавлении новых аминокислот к карбоксильного (C-) конца цепочки, растет. Этот полипептидную цепочку выходит из рибосомы через выходной туннель в большой субъединицы.
Элонгация начинается, когда метилированных аминоацил-тРНК связывается с участком P, приводит к конформационной изменения комплекса, открывает участок A для связывания новой аминоацил-тРНК. Это связывание облегчается фактором элонгации Tu (EF-TU), малой ГТФазою. В этот момент участок P содержит начало полипепдидного цепочки, синтезируется, а участок A содержит следующую аминокислоту, которая должна быть добавлена к цепочке. После этого полипептид отделяется от тРНК в области P и пептидный связь формируется между последней аминокислотой полипептида и аминокислотой, все еще присоединена к тРНК в области A. Этот процесс, известный как образование пептидной связи, катализируемой рибозимов, пептидилтрансферазою, такая активность присуща к 23S рРНК большой (50S) рибосомной субъединицы. После образования пептидной связи, участок A содержит полипептид, тогда как участок P содержит незаряженную тРНК (тРНК без аминокислоты).
На конечной стадии элонгации, рибосома перемещается на три нуклеотида в направлении 3 ‘конца мРНК. Так что тРНК связанные с мРНК за счет спаривания кодон-антикодон, тРНК движется относительно рибосомы, двигая полипептид с участка A в область P, а незаряженная тРНК перемещается в область выхода (участок E). Этот процесс катализируется фактором элонгации G (EF-G).
Рибосомы продолжает транслировать кодоны оставшиеся потому что новые аминоацил-тРНК звьязуютьться с участком A, пока рибосома не встретит кодон остановки на мРНК (UAA, UGA или UAG).
Терминация и переработка
Терминация происходит, когда один из трех стоп-кодонов перемещается в область A. Эти кодоны не имеют соответствующих тРНК. В свою очередь, их признают специальные белки — факторы терминации (англ. Release factors, RF), а именно RF1 (распознающий стоп-кодоны UAA и UAG) или RF2 (распознающий стоп-кодоны UAA и UGA). Третий фактор освобождения RF-3 катализирует освобождение RF-1 и RF-2 в конце процесса терминации. Эти факторы катализируют гидролиз эфирной связи, связывающей тРНК с пептидом, и высвобождение недавно синтезированного белка с рибосомы.
Пост-терминационного комплекс, сформированный после терминации, состоит из мРНК со стоп-кодоном в области A рибосомы и тРНК. Шаг переработки рибосомы отвечает за разборку пост-трансляционного рибосомного комплекса. Как только протеин, который синтезируется, освобождается после терминации, факторы переработки рибосомы и фактор элонгации EF-G освобождают мРНК и тРНК с рибосомы и разъединяют 70S рибосомы на 30S и 50S субъединицы. IF-3 также помогает процессу переработки, предотвращая повторное связывание субъединиц за счет связывания с 30S субъединицей. Этот процесс готовит рибосому для повторения цикла трансляции.
Полисомы
Трансляция обычно осуществляется более чем одной рибосомой одновременно. Из-за относительно большой размер рибосом, они могут связываться с участками мРНК на расстоянии не менее 35 нуклеотидов. Несколько рибосом и молекула мРНК, по которой они движутся, называются полисомы или полирибосомами.
Механизм трансляции эукариот
Кэп-зависимая инициация
С помощью этого механизма транслируется подавляющее число эукариотических мРНК. Белки, участвующие в процессах инициации трансляции у эукариот называют eIF (англ. Eukaryotic Initiation Factors — эукариотические факторы инициации). Кроме факторов инициации eIF1, eIF2 и eIF3, связывающиеся с малой рибосомной субъединицей (40S), и по своим функциям приблизительно аналогичными соответствующим белкам прокариот, эукариоты имеют еще две группы факторов инициации: семейство факторов, связывающих мРНК — eIF4 и семейство факторов, связываются с большой (60S) субъединицей рибосомы, eIF5. Ниже приведен список основных факторов:
- eIF4A — РНК геликазы, фермент, расплетает вторичную структуру мРНК для того, чтобы рибосома могла по ней двигаться.
- eIF4B — привлекает фактор eIF4A к молекуле мРНК.
- eIF4E — связывает кэп, 7-метилгуанин, расположенный на 5′-конце молекулы мРНК.
- eIF4G — нужен для организации компонентов, участвующих в инициации трансляции, в единый комплекс. Содержит участки связывания eIF4B, eIF4E, рибосомы.
- eIF5 — нужен для привлечения большой субъединицы рибосомы.
На первом этапе инициации трансляции имела субъединица рибосомы в комплексе с факторами инициации eIF4G, eIF4B, eIF4E и инициаторным тРНК присоединяется к 5′-концу мРНК за счет способности eIF4E связывать кэп-структуру, а белка eIF3 — мРНК. Затем белок eIF4B привлекает геликазу eIF4A, и та начинает расплетать мРНК в направлении к 3′-концу, что сопровождается затратами энергии в форме молекул АТФ. За счет работы этого белка, 40S субъединица освобождается от белков eIF4G и eIF4E, и в комплексе с факторами инициации оставшиеся движется по мРНК к инициаторным кодона AUG, где происходит диссоциация факторов инициации, остались, и привлечение 60S-субъединицы рибосомы с помощью eIF5, после чего начинается синтез полипептидной цепочки.
Кэп-независимая инициация
Тогда как в большинстве случаев эукарио трансляция требует наличия кэпа на 5 ‘конце мРНК, некоторые вирусные и клеточные мРНК обходят кэп-зависимый механизм за счет инициации трансляции на определенных последовательностях внутри молекулы РНК.
Лучше исследованным (но далеко не единственным) примером кэп-независимой трансляции у эукариот является так называемая «внутренняя участок входа рибосомы» (англ. Internal Ribosome Entry Site или IRES). В отличие от кэп-зависимого механизма, кэп-независимый механизм также не требует сканирования рибосомой от 5′-конца рибосомы в стартовый кодона. Рибосомы могу быть доставлена в стартовой участки IRIS с помощью ITAFьив, (IRES trans-acting fantors), позволяющие обходить необходимость сканирования от 5′-конца РНК.
Этот метод трансляции был найден относительно недавно, и необходимо в условиях, которые требуют трансляции определенных мРНК в стрессовых условиях, когда общая эффективность трансляции уменьшена. Примеры включают факторы, вызывающие апоптоз, иммуноглобулины, некоторые факторы роста. Кроме того, этим механизмом иногда пользуются вирусы.
Элонгация
Элонгация трансляции эукариот очень похожа на элонгации трансляции прокариот. Основными факторами элонгации являются:
- eEF-1, чьи α и βγ субъединицы отвечают прокариотических факторам EF-TU и EF-TS, соответственно;
- eEF-2, что соответствует прокариотических фактора EF-G
Терминация
У эукариот существует только один фактор высвобождения, eRF, вместо трех факторов прокариот. Однако, в целом процесс терминации подобен процессу терминации прокариот.
Трансляция вручную
Принцип
Для определения полипептидной последовательности возможно провести процесс переложения последовательности ДНК в последовательность аминокислот, так называемую «трансляцию вручную» (для коротких последовательностей) или трансляцию на компьютере. На первом этапе необходимо перевести последовательность ДНК в последовательность РНК, заменяя нуклеотиды A, T, C, G в ДНК на U, A, G, C в РНК, соответственно.
Затем РНК разбивается на тринуклеотидних последовательности (кодоны). Отметьте, что существует 3 «рамки считывания», или способы интерпретации кода в зависимости от того, на каком нуклеотиде начнется трансляция.
Наконец, используется так называемая «таблица трансляции» для перевода каждого кодона в соответствующую аминокислоту. В результате получается первичная структура белка.
Однако, белок также имеет структуру высшего порядка (вторичную, третичную и четвертную) или конформацию, которая определяется наличием гидрофобных и электростатических взаимодействий между частями полипептидной цепочки. Тогда как вторичная структура (структура «доменов» — коротких участков белка) еще может буди предусмотрена с помощью последовательности, надлежащая третичная структура обычно тяжелая для определения теоретически, и даже в природе выбор третичной структуры часто зависит от взаимодействия с другими белками.
Трансляция вручную в некоторых случаях также не дает правильной аминокислотной последовательности природного белка, в частности, если кодируется нестандартная аминокислота, например селенцистеин, который кодируется с помощью обычного стоп-кодона в сочетании с «шпилькой», расположенной дальше в последовательности (последовательность вставки селеноцистеина, Selenocysteine Insertion Sequence или SECIS).
Таблицы трансляции
Для большинства эукариот обычно используется стандартная таблица трансляции, в которой каждой аминокислоте соответствует одна или несколько последовательностей ДНК:.
AAs = FFLLSSSSYY ** CC * WLLLLPPPPHHQQRRRRIIIMTTTTNNKKSSRRVVVVAAAADDEEGGGG Starts = --- M --------------- M --------------- M ---- ------------------------ Base1 = TTTTTTTTTTTTTTTTCCCCCCCCCCCCCCCCAAAAAAAAAAAAAAAAGGGGGGGGGGGGGGGG Base2 = TTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGG Base3 = TCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAG
Не все организмы используют одинаковый генетический код. Даже работая с генетическими последовательностями обычных эукариотических организмов, например дрожжей, часто желательно использовать альтернативные таблицы трансляции — а именно для транслиции митохондриальных генов. Сейчас группа таксономии NCBI определяет следующие таблицы для последовательностей, содержит GenBank:
1 установлен код 2: Митохондриальный код позвоночных 3: Митохондриальный код дрожжей 4: Митохондриальный код слизистых грибков, простейшие и кишковопорожниних, и микоплазмы / спироплазма 5: Митохондриальный код беспозвоночных 6: Ядерный код жгутиковых, Dasycladacea и Hexamita 9: Митохондриальный код голошкирих и плоский червей 10: Ядерный код Euplotida 11: Бактериальный код и пластидних код растений 12: Альтернативный ядерный код дрожжей 13: Митохондриальный код асцидий 14: Альтернативный митохондриальный код плоских червей 15: Ядерный код Blepharisma 16: Митохондриальный код Chlorophycea 21: Митохондриальный код Trematoda 22: Митохондриальный код Scenedesmus obliquus 23: Митохондриальный код Thraustochytrium
Компьютерная трансляция
Существует много компьютерных программ, способных к трансляции последовательности ДНК / РНК в белковую последовательность. Однако, немного программ способны выдавать правильную последовательность во всех «особых» случаях, таких как использование альтернативных инициаторных кодонов. Например редкий код альтернативного кодона инициации TTG используется для метионина, когда используется как инициаторным кодон, и для лейцина в остальных случаях.
Изображения по теме
— трансляция — Биохимия
Трансляция (синтез белка)
Трансляция (англ. translation – перевод) – это биосинтез белка на матрице мРНК.
После переноса информации с ДНК на матричную РНК начинается синтез белков. Каждая зрелая мРНК несет информацию только об одной полипептидной цепи. Если клетке необходимы другие белки, то необходимо транскрибировать мРНК с иных участков ДНК.
Биосинтез белков или трансляция происходит на рибосомах, внутриклеточных белоксинтезирующих органеллах, и включает 5 ключевых элементов:
- матрица – матричная РНК,
- растущая цепь – полипептид,
- субстрат для синтеза – 20 протеиногенных аминокислот,
- источник энергии – ГТФ,
- рибосомальные белки, рРНК и белковые факторы.
Выделяют три основных стадии трансляции: инициация, элонгация, терминация.
Инициация
Для инициации необходимы мРНК, ГТФ, малая и большая субъединицы рибосомы, три белковых фактора инициации (ИФ-1, ИФ-2, ИФ-3), метионин и тРНК для метионина.
В начале этой стадии формируются два тройных комплекса:
- первый комплекс – мРНК + малая субъединица + ИФ-3,
- второй комплекс – метионил-тРНК + ИФ-2 + ГТФ.
После формирования тройные комплексы объединяются с большой субъединицей рибосомы. В этом процессе активно участвуют белковые факторы инициации, источником энергии служит ГТФ. После сборки комплекса инициирующая метионил-тРНК связывается с первым кодоном АУГ матричной РНК и располагается в П-центре (пептидильный центр) большой субъединицы. А-центр (аминоацильный центр) остается свободным, он будет задействован на стадии элонгации для связывания аминоацил-тРНК.
События стадии инициации
После присоединения большой субъединицы начинается стадия элонгации.
Элонгация
Для этой стадии необходимы все 20 аминокислот, тРНК для всех аминокислот, белковые факторы элонгации, ГТФ. Удлинение цепи происходит со скоростью примерно 20 аминокислот в секунду.
Элонгация представляет собой циклический процесс. Первый цикл (и следующие циклы) элонгации включает три шага:
- Присоединение аминоацил-тРНК (еще второй) к кодону мРНК (еще второму), аминокислота при этом встраивается в А-центр рибосомы. Источником энергии служит ГТФ.
- Фермент пептидилтрансфераза осуществляет перенос метионина с метионил-тРНК (в П-центре) на вторую аминоацил-тРНК (в А-центре) с образованием пептидной связи между метионином и второй аминокислотой. При этом уже активированная СООН-группа метионина связывается со свободной NH2-группой второй аминокислоты. Здесь источником энергии служит макроэргическая связь между аминокислотой и тРНК.
- Фермент транслоказа перемещает мРНК относительно рибосомы таким образом, что первый кодон АУГ оказывается вне рибосомы, второй кодон (на рисунке ) становится напротив П-центра, напротив А-центра оказывается третий кодон (на рисунке ). Для этих процессов необходима затрата энергии ГТФ. Так как вместе с мРНК перемещаются закрепленные на ней тРНК, то инициирующая первая тРНК выходит из рибосомы, вторая тРНК с дипептидом помещается в П-центр.
Последовательность событий стадии элонгации
Второе повторение цикла – начинается с присоединения третьей аминоацил-тРНК к третьему кодону мРНК, аминокислота-3 становится в А-центр. Далее трансферазная реакции повторяется и образуется трипептид, занимающий А-центр, после чего он смещается в П-центр в транслоказной реакции..
В пустой А-центр входит четвертая аминоацил-тРНК и начинается третий цикл элонгации:
Образование пептидной связи при встраивании четвертой аминокислоты в пептид.
Субъединицы рибосомы, большая часть транспортных РНК и матричная РНК не показаны.
Цикл элонгации (реакции 1,2,3) повторяется столько раз, сколько аминокислот необходимо включить в полипептидную цепь.
Терминация
Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. Данные триплеты не кодируют ни одной из аминокислот, их также называют нонсенс-кодоны. При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют:
- Гидролитическое отщепление полипептида от конечной тРНК.
- Отделение от П-центра последней, уже пустой, тРНК.
- Диссоциацию рибосомы.
Источником энергии для завершения трансляции является ГТФ.
Реакции стадии терминации
Полирибосомы
По причине того, что продолжительность жизни матричной РНК невелика, перед клеткой стоит задача использовать ее максимально эффективно, т.е. получить максимальное количество «белковых копий». Для достижения этой цели на каждой мРНК может располагаться не одна, а несколько рибосом, встающих последовательно друг за другом и синтезирующих пептидные цепи. Такие образования называются полирибосомы.
Трансляция в биологии — это поэтапный белковый синтез
В этой статье пойдет речь о жизненно важном для всех клеток явлении. Если кратко, трансляция в биологии представлена в виде белкового синтеза. Здесь мы рассмотрим ее этапы, их особенности протекания и многое другое.
Ознакомление с понятием трансляции в биологии. Что это такое?
Итак. Процессы белкового синтеза при помощи аминокислот, используемые в качестве строительного материала, на матрицах информационных рибонуклеиновых кислот (иРНК, мРНК) называют трансляцией в биологии. Это явление занимает одно из ключевых мест в развитии всех живых организмов. Так как белки являются важнейшими органическими соединениями среди известных липидов, углеводов, нуклеиновых кислот. Процесс трансляции осуществляется с участием рибосомы, она занимает основную роль в синтезе.
Принцип устройства механизма
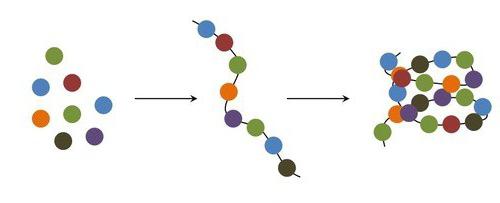
Что такое трансляция биологии? Это, в первую очередь, основной процесс клеточной жизнедеятельности. Чтобы осуществить его, клетке необходимо наличие органел немембранного типа, называемых рибосомами. Рибосомами называют рибонуклеопротеидные структуры, состоящие из малых и больших субъединиц, каждой по одной. Рибосома занимается распознаванием кодонов, состоящих из трех букв мРНК. Далее происходит сопоставление с комплементарными антикодонами транспортной рибонуклеиновой кислотой, которая несет в себе ряд аминокислот и объединяет их с возрастающей белковой молекулой, ее цепью. Передвигаясь вдоль матричной РНК, рибосомы занимаются белковым синтезом, информация о котором заложена в самой матричной РНК.
Трансляция в биологии – это жизненно важный процесс, в котором узнавание клеточных аминокислот осуществляется при помощи «адаптеров». Они представляют собой молекулы РНК транспортного типа. Процесс соединения аминокислот с транспортной РНК носит характер энерго-зависимой, ферментативной, аминоацил-тРНК реакции.
Теперь, зная где происходит трансляция в биологии, а именно на матрице, рассмотрим этот механизм у эукариот и прокариот. Важно знать, что данное явление чрезвычайно сильно отличается у этих надцарств. Множество веществ, которые подавляют трансляцию у организмов прокариотического типа, гораздо слабее воздействуют на этот же процесс у многоклеточных организмов, что дает возможность эксплуатировать их в науке медицины. В трансляции выделяют этапы инициации, элонгации и терминации.
Существует понятие о рамке считывания. Его суть заключается в том, что наличие в кодоне трех нуклеотидов, создает возможность разного способа считывания текста генетической природы. Появляется три варианта его чтения, каждый из которых начинается с 1-го, 2-го или 3-го нуклеотида. Чаще всего важной является одна рамка, однако бывают и интересные исключения. Из этого следует, что позиционирование рибосомы на ее стартовом этапе будет очень важным.
Процесс инициации
Белковый синтез, чаще всего, берет свое начало от AUG-кодонов, которые занимаются кодировкой метионина. Такой кодон именуют инициаторым. Трансляционная инициация должна узнаваться рибосомой и привлекать к себе аминоацил транспортной РНК. А также важным пунктом в процессе инициации является наличие некоторых последовательностей нуклеотидов в области начального кодона. Наличие начальной последовательности AUG жизненно важно, так как в ином случаи синтез протекал бы в хаотичном порядке.
Инициация не может происходить без участия факторов инициации, особых белковых молекул. Устройство механизмов трансляционной инициации у эу- и прокариот различаются также тем, что рибосомы прокариотических организмов могут определять местоположения стартового AUG и начинать инициацию в любом участке матричной РНК. Рибосомы эукариот, как правило, соединяются с матричной РНК на участке кэпа и начинают сканирование, что направленно на поиск стартовых кодонов.
Введение в элонгацию
Трансляция в биологии – это поэтапный процесс, часть которого мы уже рассмотрели в пункте об инициации. Теперь рассмотрим элонгацию.
Наращивающий процесс цепи полипептидного типа осуществляется с участием двух факторов элонгации, белковых молекул. Первый фактор занимается доставкой аминоацилированной транспортной РНК к А-сайту рибосомы. В эукариотах этим занимается EF1а, а в прокариотах – EF-Tu. Рибосоме выпадает роль катализатора для пептидного переноса от транспортной РНК в Р и А-сайты, что образуются пептидными связями путем взаимодействия с остатками аминокислот. Это обуславливает рост пептидной цепи за счет аминоостатков. Далее вступает в процесс другой белок, роль которого заключается в катализе транслокации. EF2 – эукариоты, EF-G – прокариоты. Транслокацией именуют явление переноса рибосомы вдоль матричной РНК на 1 триплет. По завершению этого пути, рибосома вновь способна начинать цикл элонгации.
Заключительные этапы синтеза
В биологии трансляция – это не только стадии инициации и элонгации, но и терминация. Которая представляет собой завершительный этап белкового синтеза. Она протекает на рибосомном А-сайте, и для этого необходимо наличие одного из останавливающих кодонов: UAA, UAG, UGA. При этом, пептидил транспортной РНК продолжает оставаться связанным с Р-сайтом. На этом моменте в «игру» вступают белки RF 1 и 2, играющие роль катализаторов для отщепления цепи полипептидной природы от матричной РНК. Также здесь есть RF 3. Он обуславливает диссоциацию матричной РНК из рибосом. Терминация протекает качественнее со стоп-кодоном uaa.
Подводя итоги
Трансляция в биологии (казакша – иногда можно встретить данное название при поиске, что связанно с многочисленными поисками людей из стран СНГ) – является чрезвычайно важным процессом, необходимым для синтеза белковых молекул. Без этого процесса невозможным было бы наличие жизни на планете Земля. Трансляция имеет поэтапное строение, использует разнообразные белки. Сильно отличается между про- и эукариотами.
инициация — это… Что такое инициация?
ИНИЦИАЦИЯ — ИНИЦИАЦИЯ (от лат. initiatio вводить, посвящать в таинство) общее название системы ритуалов и обрядов, обозначающих изменение социального, полового или возрастного статуса. В узком значении слова инициация есть характерное главным образом для … Философская энциклопедия
инициация — (от лат. initio начинать, посвящать в таинство; initiatio совершение таинств). Комплекс действий (в основном обрядовых), посредством к рых совершенствуется и формально закрепляется смена социального статуса (см. статус социальный) индивида,… … Большая психологическая энциклопедия
инициация — инициирование; ритуал Словарь русских синонимов. инициация сущ., кол во синонимов: 1 • ритуал (7) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
инициация — и, ж. ( … Словарь иностранных слов русского языка
ИНИЦИАЦИЯ — англ. initiation; нем. Initiation. 1. Совокупность соц. предписаний и церемоний, посредством к рых отмечается вступление индивида в члены группы, изменение его статуса, начало новой формы жизнедеятельности. 2. Возрастные посвятительные церемонии … Энциклопедия социологии
инициация — и, ж. iniciation f.<лат. лат. initiatio. Посвящение в таинства. Мак. 1908. О Инициаци <примеч.: Принятие в число знающих некоторые священныя таинства, сокрытыя от непросвещенных, в обряды с тем принятием соединенные. В нашем языке нет сего… … Исторический словарь галлицизмов русского языка
инициация — Обряд посвящения. [http://www.lexikon.ru/sexology.html] Тематики сексология … Справочник технического переводчика
Инициация — Проверить нейтральность. На странице обсуждения должны быть подробности … Википедия
ИНИЦИАЦИЯ — (Initiation от лат. initio начинать, посвящать) переход индивида из одного статуса в другой, в частности включение в некоторый замкнутый круг лиц (в число полноправных членов племени, в мужской союз, эзотерический культ, круг жрецов, шаманов и т … Словарь по аналитической психологии
Инициация — (лат. – начинать, посвящать) – обряд ритуального посвящения человека в новый возрастной статус. Это сложный процесс подготовки человека к выполнению новой возрастной роли, к серьезным изменениям в своей жизни, затрагивающим и душу, и тело.… … Основы духовной культуры (энциклопедический словарь педагога)
ИНИЦИАЦИЯ — (от лат. initiare начинать, посвящать) образ посвящения в знания и приобщения к традиции. Как правило, совершалась в племенном обществе при достижении соответствующей возрастной границы. Представляла собой принятие подростков в категорию… … Символы, знаки, эмблемы. Энциклопедия
15.3A: Инициирование транскрипции в эукариотах
Инициация является первым этапом эукариотической транскрипции и требует для продолжения РНКП и нескольких факторов транскрипции.
Задачи обучения
- Опишите, как транскрипция инициируется и протекает вдоль цепи ДНК
Ключевые моменты
- Эукариотическая транскрипция осуществляется в ядре клетки и проходит в три последовательные стадии: инициацию, удлинение и завершение.
- Эукариотам необходимы факторы транскрипции, чтобы сначала связываться с промоторной областью, а затем помогать рекрутировать соответствующую полимеразу.
- РНК-полимераза II — это полимераза, отвечающая за транскрипцию мРНК.
Ключевые термины
- репрессор : любой белок, который связывается с ДНК и, таким образом, регулирует экспрессию генов путем снижения скорости транскрипции
- активатор : любое химическое вещество или агент, который регулирует один или несколько генов путем увеличения скорости транскрипции
- полимераза : любой из различных ферментов, которые катализируют образование полимеров ДНК или РНК с использованием существующей цепи ДНК или РНК в качестве матрицы
Шаги в эукариотической транскрипции
Эукариотическая транскрипция осуществляется в ядре клетки одной из трех РНК-полимераз, в зависимости от транскрибируемой РНК, и проходит в три последовательных этапа:
- Начало
- Удлинение
- Прекращение действия.
Инициирование транскрипции у эукариот
В отличие от прокариотической РНК-полимеразы, которая может связываться с матрицей ДНК сама по себе, эукариотам требуется несколько других белков, называемых факторами транскрипции, которые сначала связываются с промоторной областью, а затем помогают рекрутировать соответствующую полимеразу. Завершенная сборка факторов транскрипции и РНК-полимеразы связываются с промотором, образуя комплекс пре-инициации транскрипции (PIC).
Наиболее изученным коровым промоторным элементом у эукариот является короткая последовательность ДНК, известная как ТАТА-бокс, обнаруженная на 25-30 пар оснований выше места начала транскрипции.Только около 10-15% генов млекопитающих содержат ТАТА-боксы, в то время как остальные содержат другие основные промоторные элементы, но механизмы, с помощью которых инициируется транскрипция на промоторах с ТАТА-боксами, хорошо изучены.
ТАТА-бокс, как основной элемент промотора, является сайтом связывания фактора транскрипции, известного как ТАТА-связывающий белок (ТВР), который сам является субъединицей другого фактора транскрипции: фактора транскрипции II D (TFIID). После того, как TFIID связывается с TATA-боксом через TBP, еще пять факторов транскрипции и РНК-полимераза объединяются вокруг TATA-бокса в серию стадий, чтобы сформировать пре-инициативный комплекс.Один фактор транскрипции, фактор транскрипции II H (TFIIH), участвует в разделении противоположных цепей двухцепочечной ДНК, чтобы обеспечить доступ РНК-полимеразы к матрице одноцепочечной ДНК. Однако только низкая, или базальная, скорость транскрипции управляется одним пре-инициационным комплексом. Другие белки, известные как активаторы и репрессоры, наряду с любыми ассоциированными коактиваторами или корепрессорами, несут ответственность за модуляцию скорости транскрипции. Белки-активаторы увеличивают скорость транскрипции, а белки-репрессоры снижают скорость транскрипции.
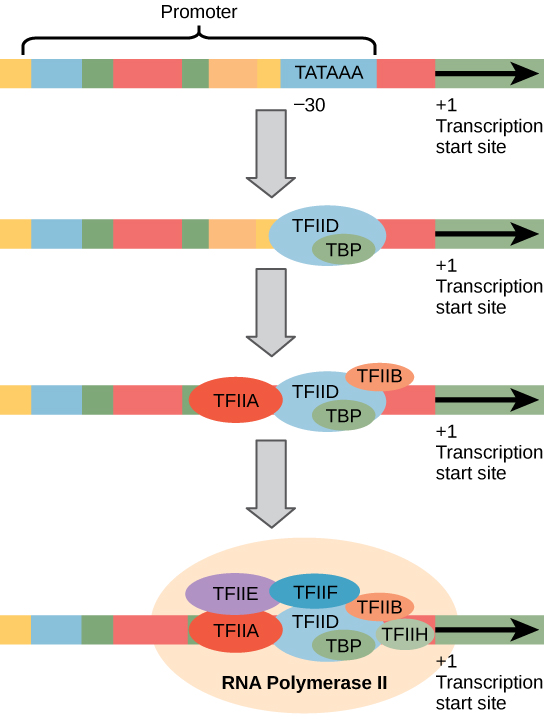 Рисунок \ (\ PageIndex {1} \): Инициирование эукариотической транскрипции : показан обобщенный промотор гена, транскрибируемого РНК-полимеразой II. Факторы транскрипции распознают промотор, затем РНК-полимераза II связывается и образует комплекс инициации транскрипции.
Рисунок \ (\ PageIndex {1} \): Инициирование эукариотической транскрипции : показан обобщенный промотор гена, транскрибируемого РНК-полимеразой II. Факторы транскрипции распознают промотор, затем РНК-полимераза II связывается и образует комплекс инициации транскрипции.
Три эукариотических РНК-полимеразы (РНКП)
Особенности синтеза мРНК эукариот значительно сложнее, чем у прокариот. Вместо одной полимеразы, содержащей пять субъединиц, у эукариот есть три полимеразы, каждая из которых состоит из 10 субъединиц или более.Каждая эукариотическая полимераза также требует особого набора факторов транскрипции, чтобы доставить ее в матрицу ДНК.
РНК-полимераза I расположена в ядрышке, специализированной ядерной субструктуре, в которой рибосомная РНК (рРНК) транскрибируется, процессируется и собирается в рибосомы. Молекулы рРНК считаются структурными РНК, потому что они играют клеточную роль, но не транслируются в белок. РРНК являются компонентами рибосомы и необходимы для процесса трансляции.РНК-полимераза I синтезирует все рРНК, кроме молекулы 5S рРНК.
РНК-полимераза II расположена в ядре и синтезирует все ядерные пре-мРНК, кодирующие белок. Пре-мРНК эукариот подвергаются обширному процессингу после транскрипции, но перед трансляцией. РНК-полимераза II отвечает за транскрипцию подавляющего большинства эукариотических генов, включая все гены, кодирующие белок, которые в конечном итоге транслируются в белки и гены для нескольких типов регуляторных РНК, включая микроРНК (miRNA) и длинно-кодирующие РНК (lncRNA) .
РНК-полимераза III также находится в ядре. Эта полимераза транскрибирует множество структурных РНК, включая 5S пре-рРНК, трансфертные пре-РНК (пре-тРНК) и небольшие ядерные пре-РНК. ТРНК играют важную роль в трансляции: они служат в качестве адаптерных молекул между матрицей мРНК и растущей полипептидной цепью. Малые ядерные РНК выполняют множество функций, включая «сплайсинг» пре-мРНК и регулирующие факторы транскрипции. Не все миРНК транскрибируются РНК-полимеразой II, РНК-полимераза III транскрибирует некоторые из них.
Моделирование транскрипции : это интерактивное моделирование процесса транскрипции ДНК в эукариотической клетке.
.
Инициирование синтеза белка
Начало синтеза белка
Аппарат синтеза белка должен выбрать подходящие отправные точки для считывания мРНК и образования пептидной связи. В качестве стартового кодона обычно используется AUG, и практически все белки начинаются с метионина. AUG также является кодоном для метионина, который также находится внутри белка, поэтому должен быть механизм, позволяющий различать два типа кодонов метионина.
Этапы инициации происходят на изолированной малой субъединице (30S) прокариотической рибосомы. Рибосомы содержат две субъединицы, субъединицу 30S и 50S, которые связываются с образованием частицы 70S. (Значения S относятся к скорости, с которой каждый компонент оседает в ультрацентрифуге; они не всегда складываются.) В целом, субъединица 30S в основном участвует в процессе декодирования и взаимодействия тРНК-мРНК, а субъединица 50S — участвует в собственно синтезе пептидной связи.Рибосомные субъединицы диссоциируют до реакции инициации.
Трансляция инициируется на 5′-конце мРНК. Поскольку РНК синтезируется в 5′-3′-направлении, бактериальная мРНК может начать трансляцию, пока 3′-последовательности все еще транскрибируются. Это важно для нескольких форм биологического контроля.
Специальная тРНК инициатора, тРНК met I (I означает инициатор), используется для начала синтеза белка. У бактерий эта инициаторная тРНК несет модифицированную аминокислоту N-формилметионин (fmet).Реакция формилирования переносит формильную группу от формил-тетрагидрофолата к метионил-тРНК met I + . Эта инициаторная тРНК используется для распознавания инициирующих кодонов; он не вставляет met в ответ на внутренний кодон AUG. В качестве дополнительной гарантии реакция формилирования гарантирует, что метионин-инициатор может находиться только на аминоконце синтезируемого белка.
Этап декодирования синтеза белка включает в себя пары оснований между кодонами мРНК и антикодонными последовательностями тРНК.Дальнейшее событие спаривания оснований между некодирующими областями мРНК и рРНК необходимо для выбора подходящей рамки считывания и инициирующего кодона. Бактериальные мРНК содержат богатую пуринами последовательность (называемую «Шайн-Дальгарно» или RBS , что является сокращением «Последовательность связывания рибосомы») в 5′-нетранслируемой области мРНК. Эта последовательность комплементарна 3′-концу малой субъединицы рРНК, 16S рРНК. См. Рисунок 1.
Рисунок 1
После установления спаривания оснований синтез белка начинается с первого AUG ниже RBS.Эта особенность инициации используется как форма управления трансляцией. Информационные РНК с наибольшей степенью комплементарности RBS к 16S рРНК транслируются наиболее эффективно, по-видимому, потому, что они инициируют более эффективно.
Несколько факторов белка участвуют в процессе инициации. Эти факторы обычно не входят в состав рибосомы; вместо этого они помогают сформировать активный комплекс инициации. Фактор инициации 3 (IF3) помогает держать субъединицу 30S диссоциированной от субъединицы 50S и доступной для синтеза белка.IF1 связывается с изолированной 30S субъединицей и помогает образовывать комплекс между RBS и 16S рРНК. IF2 образует комплекс с fmet ‐ tRNA met I и GTP, высвобождая IF3. После того, как комплекс содержит мРНК и инициатор fmet-тРНК, происходит следующее: GTP гидролизуется до GDP, факторы инициации высвобождаются из рибосомы, и субъединица 50S связывается с комплексом, образуя удлиненную рибосому, как показано на рисунке 2.

Рисунок 2
.
трансляции (синтез белка) у эукариот | Молекулярная биология / Генетика
На главную »Молекулярная биология / Генетика» Перевод (синтез белка) у эукариот
Последнее обновление: 11 января 2020 г., Сагар Арьял
- Трансляция включает трансляцию последовательности молекулы информационной РНК (мРНК) в последовательность аминокислот во время синтеза белка.
- Это процесс, при котором рибосомы в цитоплазме или ER синтезируют белки после процесса транскрипции ДНК в РНК.
Рибосомы

- Рибосомы обычно существуют как отдельные субъединицы, состоящие из белка и рРНК.
- Рибосомы эукариот крупнее (80S) и сложнее прокариотических рибосом (70S).
- Субъединицы объединяются, образуя рибосому, когда они связываются с мРНК около ее 5 ’конца.
- При связывании с мРНК рибосома считывает нуклеотидную последовательность от 5 ’к 3’ направлениям, синтезируя соответствующий белок от аминокислот в N-концевом (аминоконцевом) к C-концевому (карбоксильному) направлении.
- Рибосомы расположены в цитозоле, свободно плавающие или связанные с эндоплазматическим ретикулумом.
- Они служат для синтеза белков.
Сайты рибосом для трансляции белков
Каждая прокариотическая рибосома, показанная схематически, имеет три сайта связывания для тРНК.
- Сайт связывания аминоацил-тРНК (или сайт A) — это место, где во время элонгации связывается входящая аминоацил-тРНК.
- Сайт связывания пептидил-тРНК (или сайт Р) — это место, где связывается тРНК, связанная с растущей полипептидной цепью.
- Сайт выхода (или сайт E) является сайтом связывания тРНК после ее роли в трансляции и до ее высвобождения из рибосомы.
Все три сайта (A, P и E) образованы молекулами рРНК в рибосоме.

ПРОЦЕСС ПЕРЕВОДА
Общий механизм синтеза белка у эукариот в основном такой же, как у прокариот .
Однако есть и существенные отличия:
- В то время как прокариотическая рибосома имеет коэффициент седиментации 70S и субъединицы 30S и 50S, эукариотическая рибосома имеет коэффициент седиментации 80S с субъединицами 40S и 60S.
- Состав рибосомных субъединиц эукариот также более сложен, чем прокариотические субъединицы, но функция каждой субъединицы по существу такая же, как у прокариот.
- У эукариот каждая мРНК является моноцистронной, то есть без учета любых последующих реакций посттрансляционного расщепления, которые могут иметь место; мРНК кодирует единственный белок. У прокариот многие мРНК являются полицистронными, то есть они кодируют несколько белков. Каждая кодирующая последовательность в прокариотической мРНК имеет свои собственные кодоны инициации и терминации.
- Для инициации синтеза белка у эукариот требуется по крайней мере девять различных факторов инициации эукариот (eIFs) по сравнению с тремя факторами инициации (IFs) у прокариот.
- У эукариот инициирующей аминокислотой является метионин, а не N-формилметионин, как у прокариот.
- Как и у прокариот, для инициации требуется специальная тРНК инициатора, которая отличается от тРНК, которая распознает и связывается с кодонами метионина во внутренних положениях мРНК.Когда метионин заряжен, готовый начать инициацию, он известен как Met-тРНК i met
- Основное различие между инициацией трансляции у прокариот и эукариот состоит в том, что у бактерий последовательность Шайна-Дальгарно расположена в 5 ’от кодона инициации AUG и является сайтом связывания для 30S рибосомной субъединицы.
- Напротив, большинство мРНК эукариот не содержат последовательностей Шайна-Далгарно. Вместо этого рибосомная субъединица 40S прикрепляется к 5 ’конца мРНК и перемещается вниз по течению (т.е.е. в направлении от 5 ’к 3’), пока он не найдет инициирующий кодон AUG. Этот процесс называется сканированием.
- Прокариотическая трансляция не требует геликазы, предположительно потому, что синтез белка в бактериях может начаться, даже когда мРНК все еще синтезируется, тогда как у эукариот транскрипция в ядре и трансляция в цитоплазме являются отдельными событиями, которые дают время для формирования вторичной структуры мРНК.
Синтез (или трансляция) белка происходит в три этапа:
- Начало
- удлинение и
- Прекращение
Инициирование синтеза белка

- Первым шагом является образование преинициативного комплекса, состоящего из малой субъединицы рибосомы 40S, Met-тРНК i met , eIF-2 и GTP.
- Предварительно инициирующий комплекс связывается с 5 ’конца мРНК эукариот, на этапе, который требует eIF-4F (также называемого комплексом связывания кэпа) и eIF-3.
- Комплекс eIF-4F состоит из eIF-4A, eIF-4E и eIF-4G; eIF-4E связывается с 5 ’кэпом на мРНК, в то время как eIF-4G взаимодействует со связывающим поли (A) белком на поли (A) хвосте.
- eIF-4A — это АТФ-зависимая РНК-геликаза, которая раскручивает любые вторичные структуры мРНК, подготавливая ее к трансляции.
- Затем комплекс перемещается вдоль мРНК в направлении от 5 ’к 3’, пока не обнаружит инициирующий кодон AUG (i.е. сканирование).
- 5’-нетранслируемые области мРНК эукариот различаются по длине, но могут иметь длину в несколько сотен нуклеотидов и могут содержать вторичные структуры, такие как петли шпильки. Эти вторичные структуры, вероятно, удаляются инициирующими факторами сканирующего комплекса.
- Кодон инициации обычно узнаваем, потому что он часто (но не всегда) содержится в короткой последовательности, называемой консенсусом Kozak (5’-ACCAUGG-3 ’).
- После того, как комплекс расположен над инициирующим кодоном, большая рибосомная субъединица 60S связывается с образованием инициирующего комплекса 80S, этап, который требует гидролиза GTP и приводит к высвобождению нескольких факторов инициации.
Удлинение синтеза белка

- Удлинение зависит от факторов удлинения эукариот.
- Участвуют три фактора элонгации, eEF-1A, eEF-IB и eEF-2, которые имеют функции, аналогичные их прокариотическим аналогам EF-Tu, EF-Ts и EF-G.
- В конце стадии инициации мРНК позиционируется так, что следующий кодон может транслироваться во время стадии элонгации синтеза белка.
- Инициаторная тРНК занимает сайт Р в рибосоме, а сайт А готов принять аминоацил-тРНК.
- Во время удлинения цепи каждая дополнительная аминокислота добавляется к растущей полипептидной цепи в трехступенчатом микроцикле.
- Шаги в этом микроцикле:
- Размещение правильной аминоацил-тРНК в сайте A рибосомы,
- Образует пептидную связь и
- Сдвиг мРНК на один кодон относительно рибосомы.
- Хотя большинство кодонов кодируют одни и те же аминокислоты как у прокариот, так и у эукариот, мРНК, синтезируемые в органеллах некоторых эукариот, используют вариант генетического кода.
- Во время элонгации у бактерий деацилированная тРНК в сайте P перемещается в сайт E, прежде чем покинуть рибосому. Напротив, хотя ситуация еще не совсем ясна, у эукариот деацилированная тРНК, по-видимому, выбрасывается непосредственно из рибосомы.
Прекращение синтеза белка

- Прекращение удлинения зависит от факторов высвобождения эукариот.
- У эукариот фактор высвобождения эукариот eRF-1 распознает все три кодона терминации (UAA, UAG и UGA) и с помощью белка eRF-3 завершает трансляцию.
- После завершения рибосома разбирается, и завершенный полипептид высвобождается.
Ссылки
- Дэвид Хеймс и Найджел Хупер (2005). Биохимия. Третье изд. Группа Тейлор и Фрэнсис: Нью-Йорк.
- Бейли, У. Р., Скотт, Э. Г., Файнголд, С. М., и Барон, Э. Дж. (1986). Диагностическая микробиология Бейли и Скотта. Сент-Луис: Мосби.
- Мэдиган, М. Т., Мартинко, Дж. М., Бендер, К. С., Бакли, Д. Х., и Шталь, Д.А. (2015). Брока биология микроорганизмов (четырнадцатое издание). Бостон: Пирсон.
- https://en.wikipedia.org/wiki/Eukaryotic_translation
Трансляция (синтез белка) у эукариот
Категории Молекулярная биология / Генетика Теги Удлинение синтеза белка, Синтез эукариотического белка, Эукариотическая трансляция, Инициирование синтеза белка, Синтез белка, Рибосомы, Прекращение синтеза белка, Трансляция, Трансляция в эукариотах, Процесс трансляции Пост-навигация
.
Что такое биология? | Живая наука
Биология — наука о жизни. Его название происходит от греческих слов «биос» (жизнь) и «логос» (учеба). Биологи изучают структуру, функции, рост, происхождение, эволюцию и распространение живых организмов. Обычно считается, что существует не менее девяти «зонтичных» областей биологии, каждая из которых состоит из нескольких подполей.
- Биохимия: изучение материальных веществ, из которых состоят живые существа
- Ботаника: изучение растений, включая сельское хозяйство
- Клеточная биология: изучение основных клеточных единиц живых существ
- Экология: изучение того, как организмы взаимодействуют со своей средой
- Эволюционная биология: изучение происхождения и изменений разнообразия жизни с течением времени
- Генетика: исследование наследственности
- Молекулярная биология: изучение биологических молекул
- Физиология: изучение биологических молекул функции организмов и их частей
- Зоология: изучение животных, включая поведение животных
Сложность этой огромной идеи усложняется тем фактом, что эти области пересекаются.Невозможно изучать зоологию, не зная много об эволюции, физиологии и экологии. Вы не можете изучать клеточную биологию, не зная также биохимию и молекулярную биологию.
Структура понимания
Все отрасли биологии могут быть объединены в рамках пяти основных представлений о живых существах. Изучение деталей этих пяти идей обеспечивает бесконечное очарование биологических исследований:
- Теория клетки : Теория клетки состоит из трех частей: клетка — это основная единица жизни, все живые существа состоят из клеток и все остальное. клетки возникают из уже существующих клеток.
- Энергия : Все живые существа нуждаются в энергии, и энергия течет между организмами и между организмами и окружающей средой.
- Наследственность : Все живые существа имеют ДНК, и генетическая информация кодирует структуру и функции всех клеток.
- Равновесие : Все живые существа должны поддерживать гомеостаз, состояние сбалансированного равновесия между организмом и окружающей его средой.
- Evolution : это общая объединяющая концепция биологии.Эволюция — это изменение во времени, которое является двигателем биологического разнообразия.
Биология и другие науки
Биология часто изучается вместе с другими науками, такими как математика и инженерия, и даже с общественными науками. Вот несколько примеров:
- Биофизика включает сопоставление жизненных закономерностей и их анализ с помощью физики и математики, согласно Биофизическому обществу.
- По данным НАСА, астробиология — это исследование эволюции жизни во Вселенной, включая поиск внеземной жизни.
- Биогеография — это исследование распределения и эволюции форм жизни и причин распространения, согласно Дартмутскому колледжу.
- Биоматематика включает создание математических моделей для лучшего понимания закономерностей и явлений в мире биологии, согласно данным Университета штата Северная Каролина.
- Биоинженерия — это применение инженерных принципов к принципам биологии и наоборот, по данным Калифорнийского университета в Беркли.
- Социологи часто изучают, как биология может формировать социальные структуры, культуры и взаимодействия, по данным Американской социологической ассоциации.
История биологии
Наше увлечение биологией имеет давнюю историю. Даже древним людям приходилось изучать животных, на которых они охотились, и знать, где найти растения, которые они собирали для еды. Изобретение земледелия было первым великим достижением человеческой цивилизации. Медицина была важна для нас с самого начала. Самые ранние известные медицинские тексты взяты из Китая (2500 г. до н. Э.), Месопотамии (2112 г. до н. Э.) И Египта (1800 г. до н. Э.).
В классические времена Аристотель часто считался первым, кто практиковал научную зоологию.Известно, что он провел обширные исследования морской жизни и растений. Его ученик Теофраст написал один из самых ранних известных на Западе ботанических текстов в 300 г. до н. Э. о структуре, жизненном цикле и использовании растений. Римский врач Гален использовал свой опыт в ремонте гладиаторов на арене, чтобы написать тексты о хирургических процедурах в 158 году нашей эры.
В эпоху Возрождения Леонардо да Винчи рисковал порицать, участвуя в вскрытии человека и создавая подробные анатомические рисунки, которые до сих пор считаются одними из самых известных. самый красивый из когда-либо созданных.Изобретение печатного станка и возможность воспроизводить иллюстрации на дереве означало, что информацию было намного проще записывать и распространять. Одна из первых иллюстрированных книг по биологии — это ботанический текст, написанный немецким ботаником Леонардом Фуксом в 1542 году. Биномиальная классификация была открыта Каролом Линнеем в 1735 году с использованием латинских названий для группировки видов в соответствии с их характеристиками.
Микроскопы открыли новые миры для ученых. В 1665 году Роберт Гук использовал простой составной микроскоп, чтобы исследовать тонкую полоску пробки.Он заметил, что растительная ткань состоит из прямоугольных блоков, которые напомнили ему крошечные комнаты, используемые монахами. Он назвал эти единицы «ячейками». В 1676 году Антон фон Левенгук опубликовал первые рисунки живых одноклеточных организмов. Теодор Шванн добавил информацию о том, что ткани животных также состоят из клеток в 1839 году.
В викторианскую эпоху и на протяжении 19 века «естественные науки» стали чем-то вроде мании. Тысячи новых видов были обнаружены и описаны бесстрашными авантюристами, ботаниками и энтомологами.В 1812 году Жорж Кювье описал окаменелости и выдвинул гипотезу о том, что Земля претерпевала «последовательные приступы Творения и разрушения» в течение длительных периодов времени. 24 ноября 1859 года Чарльз Дарвин опубликовал «О происхождении видов» — текст, навсегда изменивший мир, показав, что все живые существа взаимосвязаны и что виды не были созданы отдельно, а возникли из наследственных форм, которые были изменены и сформированы. путем адаптации к окружающей среде.
В то время как большая часть внимания мира была сосредоточена на вопросах биологии на уровне макроскопических организмов, тихий монах исследовал, как живые существа передают черты от одного поколения к другому.Грегор Мендель теперь известен как отец генетики, хотя его статьи о наследовании, опубликованные в 1866 году, в то время остались практически незамеченными. Его работа была заново открыта в 1900 году, и вскоре последовало дальнейшее понимание наследования.
ХХ и 21 века могут быть известны будущим поколениям как начало «биологической революции». Начиная с Уотсона и Крика, объяснившего структуру и функцию ДНК в 1953 году, все области биологии расширились в геометрической прогрессии и затронули все аспекты нашей жизни.Медицина будет изменена путем разработки методов лечения, адаптированных к генетическому плану пациента, или путем объединения биологии и технологий с протезированием, управляемым мозгом. Экономика зависит от правильного управления экологическими ресурсами, баланса между потребностями человека и их сохранением. Мы можем найти способы спасти наши океаны, используя их для производства достаточного количества пищи, чтобы накормить народы. Мы можем «выращивать» батареи из бактерий или световых зданий с биолюминесцентными грибами. Возможности безграничны; биология только вступает в свои права.
Дополнительная информация от Рэйчел Росс, участника Live Science
.
